将pH=13的NaOH溶液平均分成两份,一份加适量水,另一份加入与该NaOH溶液物质的量浓度相同的适量硫酸后,pH都降低了1,则加入的水与硫酸的体积比为( )
| A.10:1 | B.11:1 | C.20:1 | D.21:1 |
下列化合物中,既有离子键,又有共价键的是()
| A.Na2O2 | B.NH3 | C.CaCl2 | D.HCl |
下列关于1S电子在原子核外出现的概率分布图(电子云)的说法中,正确的是()
| A.通常用小黑点来表示电子的多少 |
| B.小黑点密表示在该核外空间的电子数多 |
| C.小黑点密表示在该核外空间的单位体积内电子出现的概率大 |
| D.通常用小黑点来表示电子绕核作高速圆周运动 |
13CNMR(核磁共振)、15NNMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt Wuithrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N的叙述正确的是()
A.13C与15N有相同的中子数B.13C电子排布式为1s22s22p3
C.15N与14N互为同位素 D.15N的电子排布式为1s22s22p4
25 ℃时,在25 mL 0.1 mol/L的NaOH溶液中,逐滴加入0.2 mol/L的CH3COOH溶液,溶液的pH变化如下图所示,下列分析的结论中正确的是()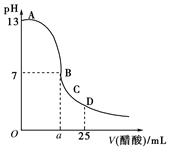
A.B点的横坐标a=12.5
B.C点时溶液中有:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.曲线上A、B间的任意一点,溶液中都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系正确的是(如图)()