写出下列离子反应方程式(8分)
(1)金属钠与水的反应:
(2)往AlCl3溶液中加入过量氢氧化钾溶液:
(3)Ca(OH)2溶液和Ca(HCO3)2溶液:
(4)将足量的CO2通入澄清石灰水:
离子反应是中学化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在________。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。

(3)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。
| ①所有的离子方程式均可以表示一类反应 |
|
| ②酸碱中和反应均可表示为:H++OH―===H2O |
|
| ③离子方程式中凡是难溶性酸、碱、盐均要用“↓” |
(4)试列举出三种不同类别的物质(酸、碱、盐)之间的反应,它们对应的离子方程式都可用“Ba2++SO42―===BaSO4↓”来表示,请写出有关反应的化学方程式(三个):
①_______________________;
②_______________________;
③_______________________。
实验室欲配制500 mL0.2mol/L的NaCl溶液。
(1)通过计算可知,应用托盘天平称量_____________克NaCl固体。
(2)本实验所需要的玻璃仪器除量筒、胶头滴管、烧杯外还有_____________________。
(3)从下面选出所需的操作并写出正确的顺序(填写相应的字母)_________________。
A、洗涤 B、干燥 C、量取 D、称量 E、定容
F、转移溶液 G、稀释 H、溶解
(4)在实验过程中出现如下情况对所配溶液的浓度有何影响(填“偏高”或“偏低”或“无影响”)
①加蒸馏水不慎超过了刻度______________________________。
②容量瓶不干燥,有一定的水分__________________________。
③仰视观察到液面刚好到达刻度线________________________。
(5)用18 mol/L的硫酸配制100mL 1.0mol/L硫酸,实验时应选用的仪器是 (填写编号)。
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.10 mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
现有九种物质:①铁单质②石墨③氯气④硫酸钡晶体⑤纯硫酸⑥盐酸⑦石灰水⑧乙醇⑨熔化的硝酸钾。
(1)其中能导电的是________________,属于电解质的是______________,既不是电解质也不是非电解质的是_________________。
(2)请写出下列反应的离子方程式:
①与③反应:_________________________。
①与⑥反应:_________________________。
③与⑦反应:_________________________。
(3)2005年3月29日,京沪高速公路发生特大氯气泄露事故,多人伤亡,附近绿地全部枯黄。翻落的氯槽罐被移至水池,用某种物质进行处理,消除了危险源,这种物质最好是 。附近居民为防止吸入氯气而引起中毒,可以用浸透某种物质的毛巾捂住口鼻,这种物质可能是 。
| A.Na2CO3 | B.NaOH |
| C.Na2O2 | D.HClO |
在25℃,101kPa下将15LO2通入10LCO和H2的混合气体中,使其完全燃烧,干燥后恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原混合气体中V(CO)= L,V(H2)= L。
(2)若剩余气体的体积是a L,则原混合气体中V(CO):V(H2)= 。
(3)若剩余气体的体积是a L,则a的取值范围是 。
标准状况下,一密闭容器被无摩擦、可滑动的两隔板a和b分成甲、乙两室,如图所示。在乙室中充入0.6mol HCl,甲室中充入NH3、H2的混合气体,静止时活塞位置如下图。已知甲、乙两室中气体的质量之差为10.9g。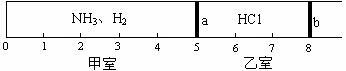
请回答下列问题:
(1)甲室中气体的物质的量为___________mol。
(2)甲室中气体的质量为__________g。
(3)甲室中NH3、H2的物质的量之比为_____________,质量比为___________。
(4)经过查资料知道HCl+NH3=NH4Cl(NH4Cl常温下是固体),如果将板a去掉,当HCl与NH3完全反应后,活塞b将静置于刻度“___________”处(填数字)。