某主族元素的原子最外层电子排布是5s1,下列描述中正确的是( )
| A.其单质常温下跟水反应不如钠剧烈 | B.其原子半径比钾原子半径小 |
| C.其碳酸盐易溶于水 | D.其氢氧化物不能使氢氧化铝溶解 |
已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g);△H<0。现将一定量NO2和 N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法错误的是
N2O4(g);△H<0。现将一定量NO2和 N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法错误的是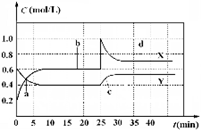
| A.图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化 |
| B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d |
| C.若要达到与d相同的状态,在25 min时还能采取的措施是适当缩小容器体积 |
| D.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4 |
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如右表,下列叙述正确的是
| 酸 |
电离平衡常数 |
| 醋酸 |
K i=1.75×10-5 |
| 次氯酸 |
K i=2.98×10-8 |
| 碳酸 |
Ki1=4.30×10-7 Ki2=5.61×10-11 |
| 亚硫酸 |
Ki1=1.54×10-2 Ki2=1.02×10-7 |
A.将0.1mol/L的醋酸加水不断稀释,c(CH3COO—)始终减小
B少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO—==CO32—+2HClO
C.少量的反应的离子方程式为:SO2+H2O+Ca2++2ClO—==CaSO3↓+2HClO
D.25℃,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中,碱性最强的是Na2CO3
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH)=0时,c(H+)=1×10-2 mol/L() |
B.V(NaOH)<10 mL时,不可能存在c(Na+)= |
| C.V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L |
| D.V(NaOH)>10 mL时,c(Na+)> c(C2O42-)> c(HC2O4-) |
常温下,pH=11的氨水和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则下列说法不正确的是()
| A.弱碱的浓度大于强酸的浓度 |
| B.反应后的溶液呈酸性 |
| C.原氨水中有1%的含氮粒子为NH |
| D.反应后的溶液中NH、NH3·H2O与NH3三种粒子的平衡浓度之和为0.05 mol/L |
下列说法中,正确的是
| A.NH4+与HCO3—均可以水解,故NH4HCO3是弱电解质 |
| B.25℃时,1L pH=3的盐酸与1L pH=11的氨水能恰好中和 |
| C.25℃时,用pH试纸测定出某醋酸溶液的pH=3.50 |
| D.25℃时,pH=14的溶液中,Na+、CO32—、K+、ClO—可以大量共存 |