控制适合的条件,KI溶液过量,将反应
2Fe3++2I-=2Fe2++I2设计成如下图所示的原电池。下列判断正确的是 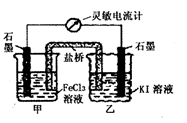
| A.反应开始时,甲中石墨电极上Fe3+发生氧化反应 |
| B.反应开始时,乙中石墨电极的反应式:I2+2e-=2I- |
| C.电流计读数为零时,在甲中加入KSCN溶液,出现血红色 |
| D.电流计读数为零时,反应处在停止状态 |
含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
| A.2.0mol/L | B.1.5 mol/L |
| C.0.18 mol/L | D.0.24mol/L |
向盛有Z溶液的洗气瓶中先通入气体X,生成沉淀;再通入过量气体Y,沉淀溶解。下列各组物质中,符合以上现象的是()
| X |
Y |
Z |
|
| A |
SO2 |
NO2 |
BaCl2溶液 |
| B |
CO2 |
NH3 |
CaCl2溶液 |
| C |
NH3 |
HCl |
AlCl3溶液 |
| D |
CO2 |
HCl |
Na2SiO3溶液 |
甲、乙两个电解池均为 Pt 电极,且互相串联,甲池盛有AgNO3溶液,乙池中盛有一定量的某盐溶液,通电一段时间后,测得甲池中电极质量增加 2.16g,乙池中电极上析出 0.24g 金属,则乙池中溶质可能是
| A.CuSO4 | B.MgSO4 | C.Al (NO3)3 | D.Na2SO4 |
溶液中含有两种溶液质—氯化钠和硫酸,他们的物质的量之比为3:1。用石墨做电极电解该溶液时,根据反应产物可明显分为三个阶段,则下列叙述不正确的是
| A.阴极只析出氢气 | B.阳极先析出氯气后析出氧气 |
| C.电解最后阶段为电解水 | D.电解过程中溶液的PH不断增大,最后pH为7 |
干电池的负极反应是:Zn –2e = Zn 2+,现以干电池作电源电解32.4g 34%的硝酸钾溶液,一段时间后,测得溶液中溶质的质量分数为36%,则干电池中消耗锌的物质的量为
| A.0.3mol | B.0.05mol | C.0.2mol | D.0.1mol |