实验室为标定一种烧碱样品的物质的量浓度,称取该烧碱样品4.0g配成1L溶液,取出20.00mL置于锥形瓶中,用0.10 mol·L-1 HCl标准溶液滴定,恰好完全中和时消耗标准盐酸19.00mL,若烧碱中只含有一种杂质,则不可能是( )
| A.NaCl | B.Ca(OH)2 | C.Na2CO3 | D.NaHCO3 |
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中不正确的是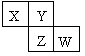
| A.原子半径:W>Z>Y>X |
| B.Y的气态氢化物的稳定性较Z的强 |
| C.W的最高价氧化物对应水化物的酸性较Z的强 |
| D.四种元素的单质中,Z的熔、沸点最高 |
如图所示,将铁棒和石墨棒插入1 L 1 mol?L-1食盐水中。下列说法正确的是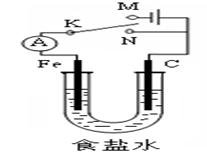
| A.若电键K与N连接,铁被保护不会腐蚀 |
| B.若电键K与N连接,正极反应式是4OH- -4e-=2H2O+O2↑ |
| C.若电键K与M连接,将石墨棒换成铜棒,铁棒上立即有铜生成 |
| D.若电键K与M连接,当两极共产生22.4 L(标准状况)气体时,生成了1 molNaOH |
下列离子方程式的书写正确的是
A.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO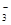 +5I +5I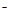 +3H2O=3I2+6OH +3H2O=3I2+6OH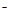 |
B.向NaOH溶液中滴加相同物质的量浓度的少量Ca(HCO3)2溶液: Ca2+ + HCO3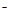 +OH +OH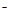 =CaCO3↓+H2O =CaCO3↓+H2O |
C.NH4HCO3溶液与过量KOH浓溶液共热:NH4++ HCO3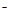 + 2OH- + 2OH- NH3↑+ 2H2O + CO32 NH3↑+ 2H2O + CO32 |
| D.稀硝酸和过量的铁屑反应:3 Fe + 8H+ +2 NO3- =" 3" Fe3+ +2 NO↑ + 4 H2O |
下述实验不能达到预期目的的是
| 编号 |
实验内容 |
实验目的 |
| A |
将AlCl 3溶液蒸干灼烧 |
制备Al 2O 3 |
| B |
向沸水中滴加几滴FeCl 3饱和溶液,继续加热至红褐色 |
制备Fe(OH) 3胶体 |
| C |
向某溶液中加入稀H 2SO 4,将产生的气体通入澄清石灰水 |
检验溶液中是否含有 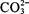 |
| D |
相同温度下,测定浓度分别为0.1 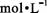 的Na 2CO 3和CH 3COONa溶液的pH 的Na 2CO 3和CH 3COONa溶液的pH |
比较  和 和 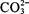 结合 结合 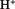 的能力强弱 的能力强弱 |
下列根据反应原理设计的应用,不正确的是
A.CO32- + H2O 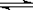 HCO3-+ OH-热的纯碱溶液清洗油污 HCO3-+ OH-热的纯碱溶液清洗油污 |
B.Al3+ + 3H2O 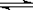 Al(OH)3 + H+明矾净水 Al(OH)3 + H+明矾净水 |
C.TiCl4+ (x+2)H2O(过量)  TiO2·x H2O↓ + 4HCl用TiCl4制备TiO2 TiO2·x H2O↓ + 4HCl用TiCl4制备TiO2 |
D.SnCl2 + H2O 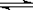 Sn(OH)Cl↓ + HCl配制氯化亚锡溶液时加入氢氧化钠 Sn(OH)Cl↓ + HCl配制氯化亚锡溶液时加入氢氧化钠 |