下列分离或提纯物质所用的方法不正确的是( )
| A.用加热的方法除去Na2CO3中混有的NaHCO3 |
| B.用分液的方法分离乙醛和水的混合物 |
| C.用萃取的方法提取碘水中的碘 |
D.用结晶的方法分离氯化钠和硝酸钾的混 合物 合物 |
下述实验能达到预期目的的是
| 编号 |
实验内容 |
实验目的 |
| A |
取两只试管,分别加入4 mL 0.01 mol/L KMnO4酸性 溶液,然后向一只试管中加入0.1 mol/L H2C2O4溶液 2 mL,向另一只试管中加入0.1 mol/L H2C2O4溶液 4 mL,记录褪色时间 |
证明草酸浓度越大,反应 速率越快 |
| B |
向含有酚酞的Na2CO3溶液中加入少量BaC12固体, 溶液红色变浅 |
证明Na2CO3溶液中存在 水解平衡 |
| C |
向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,又生成红褐色沉淀 |
证明在相同温度下的Ksp: Mg(OH)2 >Fe(OH)3 |
| D |
测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH, 后者较大 |
证明非金属性S>C |
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足图示转化关系的是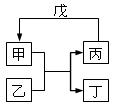
| 甲 |
乙 |
丙 |
戊 |
|
| ① |
NH3 |
O2 |
NO |
H2O |
| ② |
Fe |
H2O |
H2 |
Fe3O4 |
| ③ |
Al2O3 |
NaOH溶液 |
Na AlO2溶液 |
过量CO2 |
| ④ |
Na2O2 |
CO2 |
O2 |
Na |
A.①③ B.②③ C.②④ D.①④
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是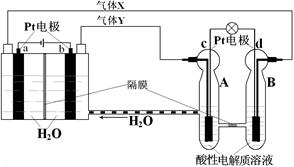
A.转移0.1mol电子时,a电极产生标准状况下O2 1.12L
B.b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH-
C.c电极上进行还原反应,B电池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
下列有关物质的性质与应用均正确的是
| A.Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒 |
| B.氨气是一种碱性气体,可用P2O5或无水CaCl2干燥 |
| C.SO2和Cl2都能使品红溶液褪色,两者等体积混合可以增强漂白能力 |
| D.油脂在碱性条件下易水解,可用于制作肥皂 |
下列离子方程式中,正确的是
A.酸性KMnO4溶液与双氧水反应:2MnO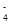 + 5H2O2 + 6H+= 2Mn2+ + 5O2↑+ 8H2O + 5H2O2 + 6H+= 2Mn2+ + 5O2↑+ 8H2O |
B.NH4HSO3溶于过量NaOH溶液中: HSO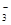 +OH- = SO32—+H2O +OH- = SO32—+H2O |
| C.向氯化银悬浊液中滴入饱和碘化钾溶液:Ag++ I-= AgI ↓ |
| D.标准状况下672mL Cl2通入100mL0.1 mol·L-1FeBr2溶液中:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |