两根金属铂做电极,以KOH溶液做电解质溶液,从两极分别通入CH4(g)和O2,则对该燃料电池的下列叙述中正确的是( )
| A.负极的电极反应式为:CH4-8e-+10OH-=CO32-+7H2O |
| B.负极的电极反应式为:4OH--4e-=2H2O+O2↑ |
| C.标准状况下,通入5.6 LO2并完全反应后,有0.50mol电子转移 |
| D.放电一段时间后,通入O2的电极附近溶液的pH降低 |
已知:
(1)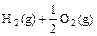 =H2O(g)△H1=a kJ·
=H2O(g)△H1=a kJ·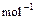

(2) =2H2O(g)△H2=b kJ·
=2H2O(g)△H2=b kJ·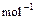
(3)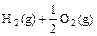 =H2O(l)△H3=c kJ·
=H2O(l)△H3=c kJ·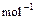
(4)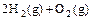 =2H2O(l)△H4=d kJ·
=2H2O(l)△H4=d kJ·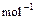
下列关系式中正确的是
| A.a<c<0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
下列过程属于熵增加的是
| A.一定条件下水由气态变为液态 |
| B.水总是由高处流向低处 |
| C.碳酸氢铵在常温情况下分解 |
| D.CO点燃时生成CO2 |
常温下,体积相同,pH相同的盐酸和醋酸两种溶液中,下列两者的量相同的是
| A.电离程度 | B.酸的物质的量浓度 |
| C.与Zn反应开始时的反应速率 | D.与足量的Zn反应产生H2量 |
在温度不变的条件下,密闭容器中发生如下反应:2SO2(g)+O2(g) 2SO3(g),下列叙述能够说明反应已经达到平衡状态的是
2SO3(g),下列叙述能够说明反应已经达到平衡状态的是
| A.容器中SO2、O2、SO3共存 |
| B.反应容器中压强不随时间变化 |
| C.容器中SO2、O2、SO3的物质的量之比为2∶1∶2 |
| D.SO2与SO3的浓度相等 |
在一密闭容器内发生反应2NH3 N2+3H2。已知NH
N2+3H2。已知NH 3起始浓度是2.6 mol/L,4s末为1.0 mol/L,若用NH3的浓度变化来表示此反应的速率,则v(N2)应为
3起始浓度是2.6 mol/L,4s末为1.0 mol/L,若用NH3的浓度变化来表示此反应的速率,则v(N2)应为
| A.1.6 mol·L-1·s-1 | B.0.2 mol·L-1·s-1 |
| C.0.4 mol·L-1 ·s-1 | D.0.8 mol·L-1 ·s-1 ·s-1 |