下列实验操作及现象与结论对应关系正确的一组是( )
| |
实验操作 |
实验现象 |
实验结论 |
| A |
适量二氧化碳通入氯化钡溶液中 |
产生沉淀 |
碳酸的酸性比盐酸弱 |
| B |
二氧化硫通入溴水中 |
溶液褪色 |
二氧化硫有漂白性 |
| C |
取少量某无色溶液,先滴加氯水,再加入少量四氯化碳,振荡、静置 |
溶液分层,下层呈橙红色 |
原无色溶液中一定有溴离子 |
| D |
将铜片放入浓硝酸中 |
产生大量无色气体,溶液变为蓝绿色 |
只体现浓硝酸的强氧化性 |
下列说法正确的是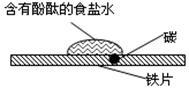
| A.氯化钠固体不导电,所以氯化钠是非电解质 |
| B.向纯水中加入碳酸钠能使水的电离平衡正向移动,水的离子积增大 |
| C.如图研究的是铁的吸氧腐蚀,实验中红色首先在食盐水滴的中心出现 |
| D.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) 的△H<0 △S<0 |
下列有关物质的性质及其解释都正确的是
| A.在漂白粉中滴入70%的硫酸,立刻产生黄绿色气体,在反应中体现硫酸的还原性 |
| B.向一定体积的稀硫酸中加入一定量的Cu、Fe和Fe2O3混合物,反应后有固体剩余,其可能只含铁 |
| C.氢氧化镁和氢氧化铝是常见的阻燃剂,它们分解时发生吸热反应 |
| D.铝在空气中表现为良好的抗腐蚀性,说明铝极难与氧气反应 |
下列说法正确的是
| A.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 |
| B.道尔顿、汤姆生、卢瑟福和门捷列夫等对原子结构模型的建立均作出了卓越的贡献 |
| C.化学反应能制造出新的物质,也能制造出新的元素,并伴有能量变化 |
| D.感染MERS致死率较高,为防止感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等适宜的物质 |
将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法正确的是
| A.标准状况下,反应过程中得到6.72 L气体 |
| B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) |
| C.最终得到7.8 g沉淀 |
| D.最终得到的溶液中c(Na+)=1.5 mol·L-1 |
在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是
A.n(Cl2)∶n(Fe)=5∶45Cl2+4Fe 2FeCl2+2FeCl3 2FeCl2+2FeCl3 |
| B.n(Cl2)∶n(FeBr2)=1∶1 Fe2++2Br-+Cl2=Fe3++Br2+2Cl- |
| C.n(MnO4-)∶n(H2O2)=2∶3 2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O |
| D.n(Fe)∶n[HNO3(稀)]=1∶3 4Fe+12H++3NO3-===3Fe2++Fe3++3NO↑+6H2O |