(12分)
(1)实验室在临时配制一些FeCl2的溶液时,常将氯化亚铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了 。稀释后还需要加入一些铁粉,其目的是 ,相关反应的离子方程式为 。
(2)氯化铁水溶液呈 性,原因是(用离子方程式表示):___________ ____ 。把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。如果要从氯化铁溶液得到纯氯化铁固体,常采用的方法是 。
(1)苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图所示:
则苯氯乙酮不可能具有的化学性质是(填字母序号)。
a.加成反应 b.取代反应 c.消去反应
d.水解反应 e.银镜反应 f.还原反应
(2)有下列化合物: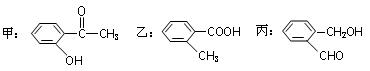
请按酸性由强至弱排列甲、乙、丙的顺序:。
(3)由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料

①聚合物F的结构简式:。
②C与新制的Cu(OH)2共热转化为D的化学方程式是:
。
③在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是:
从下列选项中选择适当的字母填空。
| A.渗析 | B.凝聚 | C.盐析 | D.布郎运动 E.电泳 F.丁达尔现象 |
(1)Fe(OH)3胶体呈红褐色,插入两个惰性电极,通直流电一段时间,阴极附近的颜色逐渐变深,这种现象叫。
(2)一束光线通过Fe(OH)3胶体,可看到光亮的通道,这种现象叫。
(3)将淀粉和食盐的混合溶液放在半透膜制成的口袋中,并把它悬挂在盛有蒸馏水的烧杯里,从而使淀粉与NaC1分离,这种方法叫。
(4)Fe(OH)3胶体加入硅酸胶体后变浑浊,这是发生了
(5)向油脂皂化反应后所得的溶液中加入细粒食盐使肥皂析出,这种操作是。
有如下转化关系: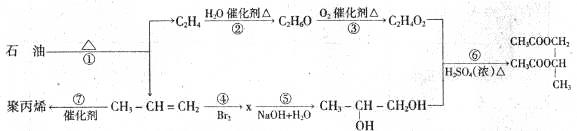
回答下列问题:
(1)实现第①步转化的方法:。
(2)(用序号填空)属加聚反应的为;属取代反应的为。
(3)写出x的结构简式:;x的同分异构体共有种。
(4)写出②、⑥反应的化学方程式:
②:
⑥:
下表中五个小实验,每个小实验有一项未填写,试按要求填空:
下表是元素周期表中短周期部分,表中所列字母分别代表一种元素,试回答有关问题。
(1)只由A、D、F三种元素组成的可为人体提供能量的营养物质是(填其中一种物质的名称)
(2)A和D可形成一种最简单化合物,它的分子构型为:。这种化合物含
键。(填“极性”或“非极性”)
(3)由上表元素中的两个原子形成的阴离子的电子式为。
(4)NH3·H2O的电离方程式为:,据此电离方程式推断NH3溶于水后的合理结构是:(填序号)。
(5)下图是A2与F2发生反应生成A2F的途径和三个状态的能量(E)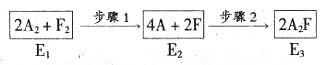
则:①步骤l是(填“吸热”或“放热”,下同)过程,步骤2是过程。
②比较E1、E2、E3的大小。(由大到小顺序排列)