(4分)配平氧化还原反应方程式。
(1) NH3+ NO2— N2+ H2O
(2) 氧化产物与还原产物的质量比为 。
(6分)按要求填空: (1)
(1) 与Ne原子电子层结构相同的
与Ne原子电子层结构相同的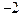 价阴离子,填写微粒的结构示意图:_____;
价阴离子,填写微粒的结构示意图:_____; (2)用电子式表示两核10电子的共价化合物形成过程:;
(2)用电子式表示两核10电子的共价化合物形成过程:; (3)在1~18号元素中,气态氢化物的水溶液呈碱性的化合物的结构式:__________ 。
(3)在1~18号元素中,气态氢化物的水溶液呈碱性的化合物的结构式:__________ 。
(4)相对分子质量为58的烷烃的分子式是_______________,
它可能的结构简式是___________________________________________________
北京市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 |
GB5461 |
| 产品等级 |
一级 |
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) |
20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+KI+H2SO4=K2SO4+I2+H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
已知Na2SO3稀溶液与I2反应后溶液显酸性,写出该反应的离子方程式
。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是。
②b中反应所产生的I2的物质的量是mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
mg/kg。
)有一瓶澄清溶液, 可能含有大量H+、NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、SO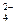 、CO
、CO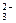 、NO
、NO 、Cl-、I-,现进行如下实验:
、Cl-、I-,现进行如下实验:




















 (1)测知溶液显强酸性;
(1)测知溶液显强酸性;
 (2)取样加少量四氯化碳和数滴新制氯水、CCl4层为紫红色;
(2)取样加少量四氯化碳和数滴新制氯水、CCl4层为紫红色;
 (3)另取样滴加稀NaOH溶液, 使溶液变为碱性, 此过程无沉淀生成;
(3)另取样滴加稀NaOH溶液, 使溶液变为碱性, 此过程无沉淀生成;
 (4)取少量上述碱性溶液, 加Na2CO3溶液出现白色沉淀;
(4)取少量上述碱性溶液, 加Na2CO3溶液出现白色沉淀;
 (5)将实验(3)中的碱性溶液加热, 有气体放出, 该气体能使湿红色石蕊试纸变蓝。
(5)将实验(3)中的碱性溶液加热, 有气体放出, 该气体能使湿红色石蕊试纸变蓝。
 由此可以推断:
由此可以推断:
溶液中肯定存在的离子有;
溶液中肯定不存在的离子有;
溶液中不能确定是否存在的离子有。
(1)气体化合物A分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为
(2)氯气与NaOH溶液吸收的离子方程式为
(10分)下列物质之间能够发生如图所示的化学反应,合金由两种金属组成,取C溶液进行焰色反应则火焰呈黄色。在反应中产生的水均未在图中标出。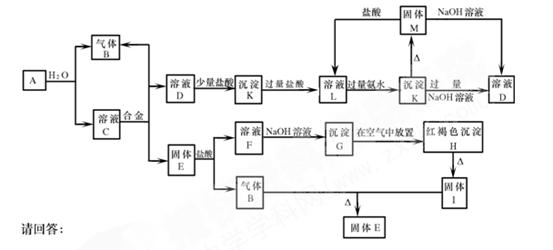
(1)写出下列物质的化学式:A:M:H:
(2)写出下列反应的化学方程式,并标出电子转移情况:
G→H:
(3)写出下列反应的离子方程式:
A→B+C:
K→D: