利用下列实验装置(依次为①—④)能完成相应实验的是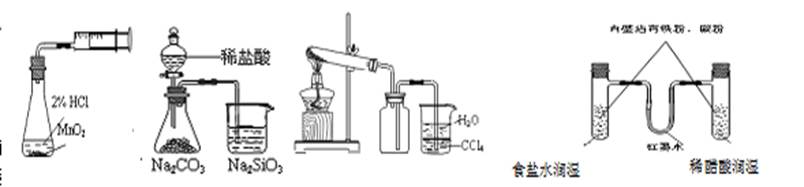
| A.实验①测定化学反应速率 | B.②能证明非金属性 Cl>C>Si |
| C.实验③室制取并收集NH3 | D.装置④模拟铁的腐蚀 |
符合下列条件的烃的一氯代物共有(不考虑立体异构)( )
①分子中碳元素与氢元素的质量之比为21:2;②含一个苯环;③相对分子质量小于150。
| A.2种 | B.3种 | C.4种 | D.5种 |
有机化合物的结构可用键线表示,如CH2=CHCH2Br可表示为 ,则有机物
,则有机物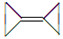 的二氯代物有()
的二氯代物有()
| A.2种 | B.3种 | C.4种 | D.5种 |
某品牌白酒中含有的塑化剂的主要成分为邻苯二甲酸二丁酯,其结构简式为 ,下列有关说法正确的是( )
,下列有关说法正确的是( )
| A.邻苯二甲酸二丁酯的分子式为C16H21O4 |
| B.邻苯二甲酸二丁酯属于酯类,可增加白酒的香味,对人体无害 |
| C.用邻苯二甲酸与丁醇合成邻苯二甲酸二丁酯的反应属于取代反应 |
| D.邻苯二甲酸二丁酯不能发生加成反应 |
某有机物的化学式为C4H8O3,现有0.1 mol该有机物分别与足量的钠、足量的碳酸氢钠溶液反应,生成标准状况下的气体分别为2.24 L H2、2.24 L CO2。则该有机物的同分异构体有(不考虑立体异构)( )
| A.3种 | B.4种 | C.5种 | D.6种 |
14.5 g某烷烃完全燃烧生成1.25 mol H2O,则该烃的一氯代物共有(不考虑立体异构)( )
| A.2种 | B.3种 | C.4种 | D.5种 |