四种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z—离子的电子数之差为8。下列说法不正确的是
| A.与W想邻的同主族元素可制成重要的半导体材料 |
| B.元素原子半径从大到小的顺序是X、Y、Z |
| C.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2YO4 |
| D.X的单质在W的最高价氧化物中的燃烧反应属于置换反应 |
甲、乙、丙为二、三周期的元素,原子序数依次增大,甲和乙同周期,甲和丙同主族,甲、乙原子序数之和与丙的原子序数相等,甲、丙原子的最外层电子数之和与乙原子的电子总数相等。下列说法不正确的是
| A.乙是地壳中含量最多的元素 |
| B.丙的氢化物比甲的氢化物热稳定性强 |
| C.乙与丙形成的化合物可制作光导纤维 |
| D.甲、乙两种元素形成的化合物中一定含有共价键 |
利用如图装置,完成很多电化学实验。下列有关此装置的叙述中,正确的是
| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓锌的腐蚀,这种方法称为牺牲阴极保护法。 |
| B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀。 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动。 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小。 |
下列电极反应正确的是
| A.用惰性电极电解饱和食盐水阳极反应式:2Cl-+ 2H+=H2↑+ Cl2↑ |
| B.碱性氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- |
| C.钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+ |
| D.铅蓄电池放电时的负极反应式为:Pb+SO42--2e-=PbSO4 |
关于铜电极的叙述中不正确的是
| A.铜锌原电池中铜是正极 |
| B.在镀件上镀铜时可用金属铜作阳极 |
| C.用电解法精炼铜时粗铜做阳极 |
| D.在电解饱和食盐水的装置可用铜做阳极,且电极产物是Cl2 |
下图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和 b 附近分别滴加一滴石蕊溶液。下列实验现象中错误的是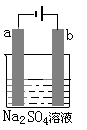
| A.a电极附近呈红色,b电极附近呈蓝色。 |
| B.a电极附近呈蓝色,b电极附近呈红色。 |
| C.逸出气体的体积,a电极的大于b电极的。 |
| D.a、b两电极都逸出无色无味气体。 |