在新制氯水的各种微粒中,
(1)使氯水呈黄绿色的是(用化学式或离子符号填写,下同) ;
(2)能使硝酸银溶液产生白色沉淀的是 ;
(3)能使紫色石蕊试液显红色的是 ;
(4)能使红纸褪色的是 ;
(5)能与碳酸氢钠溶液反应放出气体的是 ;
(6)能使KI溶液变褐色的是 。
在一定温度下将2 mol A和2 mol B两种气体混合于某2L密闭容器中,发生如下反应:3A(g)+B(g) 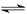 2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白:
2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白:
(1)如果缩小反应容器的体积,使压强增大,平衡体系中C的物质的量浓度_____________,C的质量分数___________,容器内气体的平均密度________________,平均相对分子质量________________。(填“增大”、“减小”或“不变”)
(2)如果上述反应在相同条件下从逆反应开始进行,开始加C和D各4/3mol,要使平衡时各物质的物质的量与原平衡相等,则还应加入__________物质___________mol。
在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g)  2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: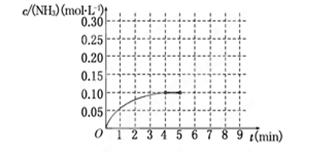
(1)根据上图,计算从反应开始到平衡时,平衡反应速率v(NH3)为______________.
(2)该反应达到平衡时H2的转化率________.
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为____________.(填序号)
a.0.20 mol·L-1 b.0.12 mol·L-1 c.0.10 mol·L-1 d.0.08 mol·L-1
(4)请写出该反应的平衡常数表达式_________,若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1K2(填“>”“="”" 或 “<” )。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.8mol液态肼和1.6mol H2O2混合反应,生成氮气和水蒸气,放出513.4kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为。
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是。
反应A(g)+B(g)  C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
(1)该反应是____________________反应(填“吸热”、“放热”)。
(2)反应体系中加入催化剂对反应热是否有影响?_______________,原因是_________.
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”、“减小”或“不变”)。
可逆反应:aA(g)+ bB(g)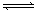 cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答: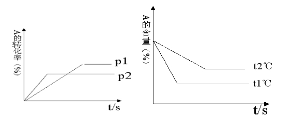
(1)压强 P1比P2(填大或小);
(2)(a +b)比(c +d)(填大或小);
(3)温度t1℃比t2℃(填高或低);(4)正反应为反应。