下列离子方程式与所述事实相符且正确的是:
| A.漂白粉溶液通入少量SO2:2ClO-+SO2+Ca2++H2O=2HClO+CaSO3↓ |
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-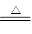 Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O |
| C.用Al单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解可生成白色难溶物,阳极的电极反应式为:Al - 3e--+3HCO3-=Al(OH)3↓+3CO2↑ |
| D.在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4: |
3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
某温度下在,密闭容器中发生如下可逆反应:2M(g)+N(g) 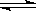 2E(g),若开始时只充入2 mol E(g),达平衡时,E的转化率为40%;若开始时充入2 mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了
2E(g),若开始时只充入2 mol E(g),达平衡时,E的转化率为40%;若开始时充入2 mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了
| A.20% | B.40% | C.60% | D.80% |
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL0.01 mol•L-1 NaHC2O4溶液中滴加0.01 mol•L-1 NaOH 溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系
正确的是
| A.V(NaOH)=0时,c(H+)=110-2 mol•L-1 |
| B.V(NaOH)=10 mL时,c(H+)=110-7 mol/L |
| C.V(NaOH)<10 mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-) |
用惰性电极电解下列溶液一段时间后,停止电解,向溶液中加入一定质量的另一种物质(括号内),可能使溶液完全复原的是
| A.CuCl2 (CuO) | B.NaOH (NaOH) |
| C.CuSO4 (Cu(OH)2 ) | D.NaCl (Cl2) |
缓冲溶液可以抗御少量酸碱对溶液pH的影响,Na2HPO4/Na3PO4的混合溶液可以将体系的pH稳定在11.3~13.3之间,是一种常用的缓冲溶液。下列有关该缓冲溶液的说法错误的是
| A.加入少量强碱,主要发生的反应HPO42-+OH- PO43-+H2O |
| B.加入少量强酸,主要发生的反应HPO42-+2H+ H3PO4 |
| C.c(Na+)+c(H+)=c(OH-)+c(H2PO )+2c(HPO )+3c(PO ) |
| D.c(Na+)>c(PO )+c(HPO )+c(H2PO )+c(H3PO4)> c(Na+) |
已知:还原性强弱:I- >Fe2+。往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
| A.1.1mol·L-1 | B.1.5mol·L-1 | C.1.2mol·L-1 | D.1.0mol·L-1 |