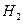下列金属冶炼的反应原理,错误的是 
右图曲线a表示放热反应X(g)+Y(g)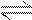 Z(g)+M(g)+N(s
Z(g)+M(g)+N(s ) 进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
) 进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
| A.加催化剂 |
| B.加大X的投入量 |
| C.升高温度 |
| D.增大体积 |
反应4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率x
4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率x
A. (O2) =" 0.01mol·(L·s)" –1 B. (NO) =" 0.002mol·(L·s)" –1
C. (H2O) =" 0.006mol·(L·s)" –1 D . (NH3) =" 0.008mol·(L·s)" –1
. (NH3) =" 0.008mol·(L·s)" –1
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的
| A.NaNO3 (溶液) | B.KCl(溶液) | C.NaCl(固体) | D.NaOH (固体) |
设C + CO2 2CO;△H>0,反应速率为v1,N2 + 3H2
2CO;△H>0,反应速率为v1,N2 + 3H2 2NH3;△H<0,反应速率为v2,对于上述反应,当温度降低时,v1和v2的变化情况为
2NH3;△H<0,反应速率为v2,对于上述反应,当温度降低时,v1和v2的变化情况为
| A.同时增大 | B.同时减小 | C.v1增大,v2减小 | D.v1减小,v2增大 |
在298K、101kPa时,已知:
2 △H1
△H1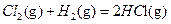 △H2
△H2 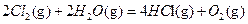 △H3
△H3
则⊿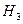 与⊿
与⊿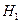 和⊿
和⊿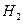 间的关系正确的是
间的关系正确的是
A .⊿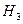 =⊿
=⊿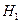 +2⊿
+2⊿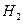 B ⊿
B ⊿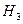 =⊿
=⊿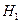 +⊿
+⊿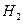
C. ⊿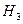 =⊿
=⊿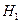 -2⊿
-2⊿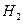 D. ⊿
D. ⊿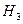 =⊿
=⊿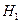 - ⊿
- ⊿