已知下列热化学方程式:Zn(s)+1/2O2(g)=ZnO(s);△H=-351.1kJ·mol-1
Hg(l)+1/2O2(g)=HgO(s);△H=-90.7 kJ·mol-1,由此可知反应:
Zn(s)+HgO(s)=ZnO(s)+ Hg(l)的△H为。
| A.△H=-1141.8 kJ·mol-1 | B.△H=+260.4kJ·mol-1 |
| C.△H=+441.8 kJ·mol-1 | D.△H=-260.4 kJ·mol-1 |
右图是某短周期同周期元素最高价氧化物对应的水化物,在某温度时,相同浓度稀溶液的pH与原子半径的关系示意图,则下列说法正确的是
| A.原子序数:W>Z>X |
| B.气态氢化物的稳定性:N>R |
| C.Y和W形成共价化合物 |
| D.X和Z两者最高价氧化物对应的水化物能相互反应 |
用惰性电极电解下列各组物质的溶液时,发生的电极反应完全相同的是
| A.NaOH、H2SO4、Na2SO4 | B.CuSO4、CuCl2、H2SO4 |
| C.NaOH、HCl、NaCl | D.KCl、NaCl、Na2SO4 |
化学与生产、生活密切相关,下列有关叙述正确的是
| A.晶体硅是"信息革命"的支柱材料,可用作光导纤维 |
| B.将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
| C.化学反应伴随着能量的变化,反应物总能量一定大于生成物总能量 |
| D.含有碳的铜与稀H2SO4长时间接触会发生吸氧腐蚀 |
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s);ΔH>0。下列叙述正确的是
Z(g)+W(s);ΔH>0。下列叙述正确的是
| A.加入少量W,逆反应速率增大 | B.升高温度,平衡逆向移动 |
| C.平衡后加入X,上述反应的ΔH增大 | D.当容器中气体压强不变时,反应达到平衡 |
某原电池装置如图所示。下列有关叙述正确的是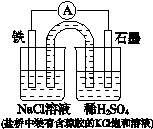
| A.Fe作正极,发生氧化反应 |
| B.负极反应: 2H+ + 2e-=H2↑ |
| C.工作一段时间后,NaCl溶液中c(Cl-)增大 |
| D.工作一段时间后,两烧杯中溶液pH均不变 |