高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是 ( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是 ( )
| A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
B.放电时正极反应为: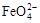 +4H2O+3e-=Fe(OH)3+5OH- +4H2O+3e-=Fe(OH)3+5OH- |
| C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |
某有机物M是合成药物的中间体,其结构如下图所示,下列说法不正确的是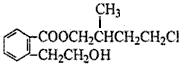
| A.M属于芳香族化合物 |
| B.M的分子式为C14H19O3Cl |
| C.1 mol M最多能消耗3 mol NaOH |
| D.M能发生取代、加成、消去反应 |
下列实验能达到相应目的的是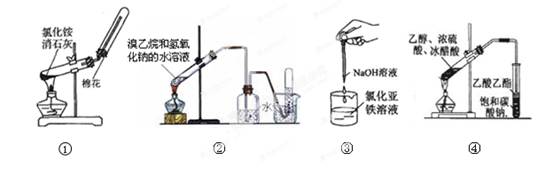
| A.用图①装置制取并收集氨气 | B.用图②装置制取和收集乙烯 |
| C.用图③装置制备氢氧化亚铁 | D.用图④装置制取乙酸乙酯 |
设NA表示阿伏加德罗常数的值,下列说法不正确的是
| A.15 g C2H6含C—H键数目为3NA |
| B.28 g乙烯与丙烯的混合气体,含碳原子总数为2NA |
| C.标准状况下,11.2 L O2与足量Na加热反应,转移电子总数为NA |
| D.铜与浓H2SO4反应,当转移电子数为NA时,收集SO2体积为11.2 L |
下列陈述Ⅰ、Ⅱ均正确并且有因果关系的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
Fe2O3是红棕色粉末 |
Fe2O3常用作红色涂料 |
| B |
SiO2是两性氧化物 |
SiO2可和HF反应 |
| C |
Al2O3难溶于水 |
Al2O3可用作耐火材料 |
| D |
SO2有氧化性 |
SO2可使溴水褪色 |
短周期元素R、T、Q、W、G在元素周期表中的相对位置如下图所示,其中Q是无机非金属材料的主角。下列判断正确的是
| R |
||||
| T |
Q |
W |
G |
A.离子半径:T< W< G
B.最简单气态氢化物的热稳定性:Q < R
C.最高价氧化物对应水化物的酸性:Q >W>G
D.T和G组成的化合物甲溶于水,其水溶液呈中性