下列叙述正确的是
| A.离子晶体中,只存在离子键,不可能存在其它化学键 |
| B.在卤族元素(F、Cl、Br、I)的氢化物中,HF的沸点最低 |
| C.NaHSO4、Na2O2晶体中的阴、阳离子个数比均为1 : 2 |
| D.晶体熔点:金刚石>食盐>冰>干冰 |
已知25℃时,AgCl 的溶度积Ksp=1.8×10-10,则下列说法正确的是
A.向饱和AgCl 水溶液中加入盐酸,Ksp值变大
B.AgNO3溶液与NaCl 溶液混合后的溶液中,一定有c(Ag+)="c(" Cl— )
C.温度一定时,当溶液中c(Ag+)×c( Cl— )=Ksp,此溶液为氯化银的饱和溶液
D 将固体AgCl 加入到较浓的KI 溶液中,部分AgCl会转化为AgI ,所以 AgCl的溶解度小于AgI
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g) 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是
A.该反应的化学平衡常数表达式是 |
| B.此时B的平衡转化率是40% |
| C.增大该体系的压强,平衡向右移动,化学平衡常数增大 |
| D.增加B,平衡向右移动,B的平衡转化率增大 |
在一密闭容器中,反应aA(g) bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡后,A的浓度变为原来的60%,则
bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡后,A的浓度变为原来的60%,则
| A.平衡向正反应方向移动了 | B.平衡向逆反应方向移动了 |
| C.物质B的质量分数增加了 | D.a<b |
常温下,用 0.1000 mol·L-1NaOH溶液滴定 20.00mL0.1000 mol·L-1某一元弱酸HA溶液滴定曲线如图。下列说法正确的是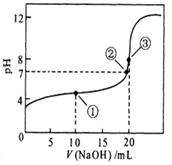
A. 点①所示溶液中:c(A-)+c(OH-) =c(HA) +c(H+)
B. 点②所示溶液中:c(Na+) = c(HA) +c(A-)
C. 点③所示溶液中:c(Na+) > c(A-)> c(OH-) > c(H+)
D. 滴定过程中可能出现:c(HA) > c(A-) > c(H+) > c(OH-)> c(Na+)
用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂—KNO3的U形管)构成一个原电池(如图)。以下有关该原电池的叙述正确的是
①在外电路中,电子由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③盐桥中K+移向CuSO4溶液
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同
| A.①② | B.①②④ | C.①②③ | D.①②③④ |