下列关于Na2CO3和NaHCO3的说法不正确的是
| A.在水中溶解度:Na2CO3> NaHC O3 | B.二者都能与酸反应生成CO2 |
| C.热稳定性:Na2CO3< NaHCO3 | D.水溶液的碱性:Na2CO3> NaHCO3 |
对于xA(g)+yB(g)  zC(g)+wD(g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变为29,则下列说法中正确的是
zC(g)+wD(g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变为29,则下列说法中正确的是
| A.x+y>z+w, 正反应是放热反应 | B.x+y>z+w,正反应是吸热反应 |
| C.x+y<z+w,逆反应是放热反应 | D.x+y<z+w,正反应是吸热反应 |
下列各离子方程式中,属于水解反应的是
A.HCO3-+H2O  H3O++CO32- H3O++CO32- |
B.NH4++H2O  NH3·H2O+OH- NH3·H2O+OH- |
C.PO43-+H2O  HPO42-+OH- HPO42-+OH- |
D.H2O+H2O  H3O++OH- H3O++OH- |
向0.1 mol·L-1醋酸溶液中逐滴加入氨水至过量时,溶液的导电能力将发生相应的变化,其电流强度(I)随加入氨水的体积(V)变化的曲线关系是下图中的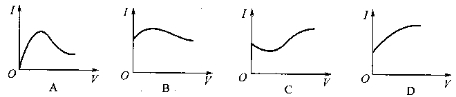
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
| A.Cl-、Br-、CrO42- | B.CrO42-、Br-、Cl- |
| C.Br-、Cl-、CrO42- | D.Br-、CrO42-、Cl- |
常温下,在BaSO4饱和溶液中加入Na2SO4固体,达到溶解平衡时,下列说法正确的是
| A.c(Ba2+)=c(SO42-) |
| B.c(Ba2+)增大,c(SO42-)减小 |
| C.c(Ba2+)≠c(SO42-),c(Ba2+)·c(SO42-)=Ksp(BaSO4) |
| D.c(Ba2+)≠c(SO),c(Ba2+)· c(SO42-)≠Ksp(BaSO4) |