过氧化钠与铝粉混合物共18.3 g,加入100 mL水,充分反应 后混合物完全溶解,并收集到5.6 L气体(标准状况)。
后混合物完全溶解,并收集到5.6 L气体(标准状况)。
(1)收集到的气体成份是 ,体积比是 ;
(2)计算反 应后溶液中各溶质的物质的量浓度(设溶液体积不变)。
应后溶液中各溶质的物质的量浓度(设溶液体积不变)。
在标准状况下,11.2LCO和CO2混合气体质量为20.4g,求混合气体中CO和CO2的体积比和质量比。
在标准状况下,100ml某气体的质量为0.179克。试计算这种气体的相对分子质量?
(8分)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为 计算:
计算:
(1)该条件下N2的平衡转化率;(小数点后保留一位)
(2)该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数。(不带单位)
N2(g)+3H2(g)的平衡常数。(不带单位)
常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算: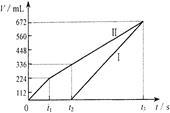
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的c(H+)。
(3)电解至t3时,消耗水的质量。
有一块表面被氧化成氧化钠的金属钠,其质量是10.8克,将它投入到100克水中,完全反应后生成标准状况下2.24L H2,试计算:
(1)未被氧化的金属钠的物质的量?
(2)被氧化成氧化钠的金属钠的物质的量?