下列离子反应方程式正确的是( )
A.用两个铜电极电解食盐水:2Cl-+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
| B.腐蚀法制作印刷线路板:Fe3++Cu====Fe2++Cu2+ |
C.以铜作电极电解硫酸铜溶液:2Cu2++2H2O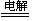 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
D.AlCl3溶液呈酸性的原因: Al3++3H2O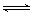 Al(OH)3+3H+ Al(OH)3+3H+ |
铁镍蓄电池又称爱迪生电池,放电时的总反应为Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是 ( )
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O |
同温同压下,已知下列各反应均为放热反应,其中放热最少的是()
| A.2A ( l ) + B ( l ) =" 2C" ( g ) ΔH1 | B.2A ( g ) + B ( g ) =" 2C" ( g ) ΔH2 |
| C.2A ( g ) + B ( g ) =" 2C" ( l ) ΔH3 | D.2A ( l ) + B ( l ) =" 2C" ( l ) ΔH4 |
根据金属活动性顺序,Ag不能发生反应:2HCl +2Ag =2AgCl+H2↑。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四组电极和电解液中,为能实现该反应最恰当的是()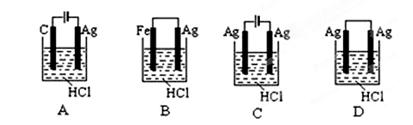
强酸与强碱的稀溶液发生中和反应的热效应为: H+(aq)+OH-(aq)===H2O(l) ΔH =-57.3kJ·mol-1。分别向1 L 0.5mol/L的NaOH溶液中加入①浓硫酸;②稀硫酸;③稀盐酸,恰好完全反应的热效应分别为ΔH1、ΔH2、ΔH3,下列关系正确的是( )
| A.ΔH1>ΔH2>ΔH3 | B.ΔH1<ΔH2<ΔH3 | C.ΔH1=ΔH2<ΔH3 | D.ΔH1<ΔH2=ΔH3 |
已知298K时下述反应的有关数据:C(s)+1/2 O2(g)=CO(g)△H1 = -110.5kJ·mol-1
C(s)+O2 (g)=CO2(g), △H2= -393.5kJ/mol则 C(s)+CO2(g)="2CO(g)" 的△H为
| A.283. kJ·mol-1 | B.+172.5 kJ·mol-1 |
| C.-172.5 kJ·mol-1 | D.-504 kJ·mol-1 |