在2 L密闭容器中放入CO(g)、H2O(g)各1 mol,发生CO(g) + H2O(g) = CO2(g) + H2(g)反应(正反应为放热反应),改变下列条件,不能使V正 增大的是
| A.升高温度 | B.降低温度 |
| C.使用催化剂 | D.压缩容器,使其体积变为1 L |
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是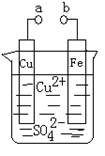
| A.a和b不连接时,铁片上发生的反应为:Cu2++Fe= Cu+Fe2+ |
| B.a和b用导线连接时, Cu2+向铁电极移动 |
| C.a和b分别连接直流电源正、负极,铜片会溶解 |
| D.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
下列叙述中,不能用平衡移动原理解释的是
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.高压比常压有利于合成NH3的反应 |
| C.由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| D.黄绿色的氯水光照后颜色变浅 |
已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H=" +74.9" kJ·mol-1,下列说法中正确的是
| A.该反应中熵变、焓变皆大于0 |
| B.该反应是吸热反应,因此一定不能自发进行 |
| C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |
| D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
下列溶液一定显中性的是
| A.将pH=5的盐酸稀释100倍后所得的溶液 |
| B.c(H+)=c(OH-)=1×10-6mol·L-1的溶液 |
| C.由强酸、强碱按等物质的量反应得到的溶液 |
| D.非电解质溶于水得到的溶液 |
反应E+F = G在温度T1下进行,反应M+N = K在温度T2下进行,已知T1>T2,且E和F的浓度均大于M和N的浓度(其它条件相同),则两者的反应速率
| A.前者大 | B.后者大 | C.一样大 | D.无法判断 |