对于下列事实的解释错误的是( )
| A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 |
| B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 |
| C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 |
| D.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 |
相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是()
| A.弱酸溶液产生较多的氢气 |
| B.强酸溶液产生较多的氢气 |
| C.两者产生等量的氢气 |
| D.无法比较两者产生氢气的量 |
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是()
| A.加热 |
| B.不用稀硫酸,改用98%浓硫酸 |
C.滴加少量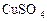 溶液 溶液 |
| D.不用铁片,改用铁粉 |
将钠、镁、铝各0.3mol分别放入100ml 1mol·L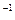 的盐酸中,同温同压下产生的气体体积比是()
的盐酸中,同温同压下产生的气体体积比是()
| A.1:2:3 | B.6:3:2 | C.3:1:1 | D.1:1:1 |
甲、乙两烧杯各盛有100ml 3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为V(甲):V(乙)=1:2,则加入的铝粉质量为()
| A.5.4g | B.3.6g | C.2.7g | D.1.8g |
由锌、铁、铝、镁四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是()
| A.锌 | B.铁 | C.铝 | D.镁 |