在配制一定物质的量浓度的盐酸溶液时,下列错误操作可使所配制溶液浓度偏高的是
| A.用量筒量取浓盐酸时俯视读数 |
| B.溶解搅拌时有液体飞溅 |
| C.定容时俯视容量瓶瓶颈刻度线 |
| D.摇匀后见液面下降,再加水至刻度线 |
下列说法不正确的是
| A.麦芽糖及其水解产物均能发生银镜反应 |
| B.用溴水即可鉴别苯酚溶液,2,4-已二烯和甲苯 |
C.在酸性条件下, 的水解产物是 的水解产物是 和 和 |
D.用甘氨酸( )和丙氨酸( )和丙氨酸( )缩合最多可形成4种二肽 )缩合最多可形成4种二肽 |
某有机物的结构简式如下图所示,则下列有关说法正确的是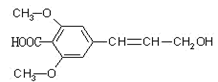
| A.该有机物可以发生氧化、加成、加聚、取代等反应 |
| B.该有机物能与NaOH溶液反应,则1mol该有机物能消耗2molNaOH |
| C.该有机物的分子式为C12H14O5,且与C11H12O5 一定互为同系物 |
| D.该有机物分子中所有碳原子不可能都在同一平面上 |
下列说法不正确的是
| A.某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种 |
B.将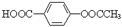 转化为 转化为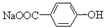 的方法是加入足量的NaOH溶液并加热,再通入足量的CO2 的方法是加入足量的NaOH溶液并加热,再通入足量的CO2 |
C.1mol某有机物的结构简式为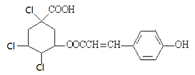 ,通过消去反应脱去1 molHCl时,能得到 5 种不同产物(不考虑立体异构) ,通过消去反应脱去1 molHCl时,能得到 5 种不同产物(不考虑立体异构) |
| D.等质量的甲烷、乙烯、1,3-丁二烯(C4H6)分别充分燃烧,所耗用氧气的量依次减少 |
制备乙酸乙酯的绿色合成路线之一为:
下列说法不正确的是
| A.M的分子式为C6H12O6 |
| B.用NaOH溶液可除去乙酸乙酯中混有的乙酸 |
| C.①、④的反应类型均属于取代反应 |
| D.N的化学式为CH3COOH |
乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述正确的是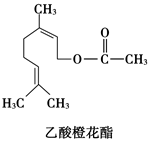
①属于芳香族化合物 ②不能发生银镜反应 ③分子式为C12H20O2
④不能使溴水褪色 ⑤1 mol该有机物水解时只能消耗1 mol NaOH
| A.②③⑤ | B.②③④ | C.①②③ | D.①④⑤ |