有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,E是_________。(请填写元素符号)
(2) 写出C元素基态原子的电子排布式_________________________。
(3) 用轨道表示式表示D元素原子的最外层电子构型____________________。
| 溶质 溶剂 |
AgNO3 |
Ba(NO3)2 |
AgCl |
BaCl2 |
| 水 |
170 |
9.3 |
1.5×10-4 |
33.3 |
| 液氨 |
86 |
97.2 |
0.8 |
0 |
(1)分别是1.0 mol·L-1的Ag+、Ba2+、NO-3和Cl-在水中发生反应的离子方程式是。
(2)分别是0.50 mol·L-1的以上四种离子在液氨中发生反应的离子方程式是
。
(3)得出以上结论的依据是。
(4)将以上四种离子按适当浓度混合于液氨之中,能否有AgCl沉淀析出?
答:________(“能”或“否”)。
(1),
(2),
(3)NH3·H2O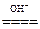 NH3↑+H2O,
NH3↑+H2O,
(4)。
(1)少量Cl2通入FeI2(aq)中,反应的离子方程式是;
(2)过量Cl2通入FeI2(aq)中,反应的离子方程式是;
(3)将1.2 mol Cl2通入含有FeI2 1.0 mol的水溶液中:。
(2)在以上中性溶液中,继续滴加Ba(OH)2(aq),请写出此步反应的离子方程式_______________。
(1)将NaAlO2(aq)和AlCl3(aq)混合:(水解相互促进,反应进行到底,下同);
(2)将10.00 mL 0.10 mol·L-1的NaHCO3(aq)与5.00 mL 0.10 mol·L-1的KAl(SO4)3(aq)混合:。