下图中A至F是化合物,G是单质,A的焰色反应为黄色。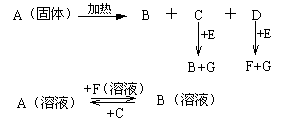
(1)写出B、C的化学式:
B ;C
(2)写出下列反应的离子方程式
①A+F: ②D+E:
(3) 若2molA与1.5molE的混和物在密闭容器中加热后,得到的固体成分为_________
(填名称)
分别用A、B、C、D四块金属片做如图所示实验,实验数据如下:
| 金属片 |
电子流动方向 |
电压表读数 |
| A |
Cu←A |
+0.67 |
| B |
Cu→B |
-0.71 |
| C |
Cu←C |
+1.35 |
| D |
Cu←D |
+0.30 |
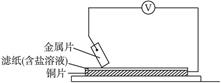
已知:构成两电极的金属活动性相差越大,电压表读数越大。请依据表中数据判断:
(1)_________金属可能是最强的还原剂。
(2)_________金属一定不能从硫酸铜溶液中置换出铜。
(3)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上能看到有蓝色沉淀析出的是_________(填字母)。金属对应的原电池的电极反应为:负极: _________,正极: _________。
A、B、C是大家熟悉的与生命运动密切相关的三种化合物,B是能造成温室效应的气体,它们所含元素不超过三种,并有如下图所示的转化关系。
回答以下问题:
(1)在A、B、C、D四种化合物中,所含元素种类完全相同的是(写字母代码和物质名称)_____________。
(2)在常温下,A和B通过_____________途径转化为C。
(3)目前,化合物B在自然界中的含量呈上升趋势,对于环境产生了不良影响,发生这种变化的主要原因是_____________。
氮化硅是一种高温陶瓷材料,结构类似于硅、二氧化硅,它的硬度大,熔点高,化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1 300 ℃反应制得。
(1)根据性质,推测氮化硅的用途是()
| A.制汽轮机叶片 | B.制有色玻璃 |
| C.制永久性模具 | D.制造柴油机 |
(2)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应,试推测该陶瓷被氢氟酸腐蚀的化学方程式_______________________________________。
(3)用四氯化硅在氢气中与氮气反应(加强热)可制得较高纯度的氮化硅,反应的化学方程式为_____________________________________________________。
已知钾云母的化学式为K2H4Al6Si6O24。改用氧化物的形式可表示为______________。
氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“拟卤素”。它们阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出:
(1)(CN)2与KOH溶液反应的化学方程式________________________________。
(2)KBr和KSCN的混合溶液中加入(CN)2反应的离子方程式为________。
(3)硫氰酸(化学式为HSCN)有两种同分异构体。目前游离酸中的这两种互变异构体尚无法分离,硫氰酸易溶于水,其水溶液有强酸性。已知:硫氰酸中的碳、氮、硫原子在一条直线上,H、S、C、N的化合价分别为+1、-2、+4、-3。则硫氰酸的可能的结构式为_______或_______。