实验室制取少量N2常利用的反应是 ,关于该反应的说法正确的是( )
,关于该反应的说法正确的是( )
| A.生成1 molN2时转移的电子为6 mol | B.NaNO2是氧化剂 |
| C.NH4Cl中的N元素被还原 | D.N2既是氧化剂又是还原剂 |
下列说法正确的是
| A.单质硅化学性质稳定,但自然界不存在游离态的硅 |
| B.氨气的水溶液能导电,说明氨气是电解质 |
| C.SO2使溴水或品红溶液褪色,体现了SO2的漂白性 |
| D.镁、铝、铜等金属一般采用热还原法冶炼 |
部分弱酸的电离平衡常数如下表,下列表述肯定正确的是
| A.相同温度时三种溶液的pH关系:Na2CO3>NaCl>Na2SO3 [ |
| B.ClO-+H2O+CO2=HClO+HCO3- |
| C.2ClO-+H2O+SO2=2HClO+SO32- |
| D.等体积、等物质的量浓度的HClO和Na2CO3混合后溶液呈中性 |
已知:25 ºC时,Mg(OH)2的Ksp=5.61×10-12,MgF2的Ksp=7.42×10-11。下列判断正确的是
A.25 ºC时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的 大。 大。 |
B.25 ºC时,在Mg(OH)2的悬浊液中加入少量的 固体, 固体,  增大 增大 |
C.25 ºC时,Mg(OH)2固体在20mL0.01mol/L氨水中的Ksp比在20mL0.01mol/L 溶液中的 溶液中的 小, 小, |
| D.25 ºC时,在Mg(OH)2的悬浊液中加入NaF溶液后Mg(OH)2不可能转化为MgF2 |
已知:常温下,0.01mol/LMOH溶液的pH为10,MOH(aq)和H2O4(aq)反应生成1mol正盐△H=-24.2kJ/mol,强酸与强碱稀溶液反应的中和热为△H=-57.3kJ/mol则MOH在水溶液中电离的△H为
如图a、b、c、d均为石墨电极,通电进行电解(电解液足量)下列说法正确的是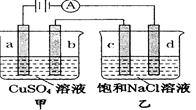
| A.向乙中加入适量盐酸,溶液组成可以恢复 |
| B.电解时向乙滴入酚酞溶液,c电极附近变红 |
| C.当b极有64gCu析出时,c电极产生2g气体 |
| D.甲中a极上的电极反应为4OH- -4e-=2H2O+O2↑ |