下列物质的溶液加热蒸发至干、灼烧,所得固体的成分不相同的是( )
| A.FeCl2、Fe2(SO4)3 | B.FeCl2、FeCl3 |
| C.NaHCO3、Na2CO3 | D.Mg(HCO3)2、MgCl2 |
分子式为C5H7Cl的有机物,其结构不可能是()
| A.只含有1个双键的直链有机物 | B.含2个双键的直链有机物 |
| C.含1个双键的环状有机物 | D.含一个三键的直链有机物 |
下列结构式从成键情况看不合理的是()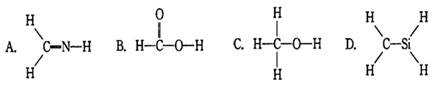
下列图示与对应的叙述相符的是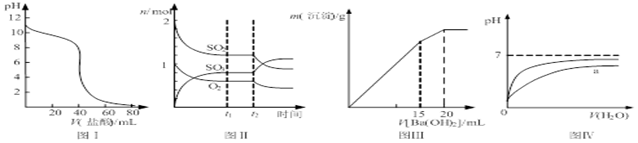
| A.图Ⅰ表示盐酸滴加到0.1 mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂 |
B.图Ⅱ表示一定条件下进行的反应2SO2+O2 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 |
| C.图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2 溶液时铝离子恰好沉淀完全 |
| D.图Ⅳ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸 |
根据下列化学实验示意图,能得出正确结论的是()
已知室温下,Ka(HF)=6.8×10-4mol·L-1,Ka(CH3COOH)=1.7×10-5 mol·L-1。关于物质的量浓度均为0.1mol/L的NaF和CH3COONa混合溶液,下列说法正确的是( )
| A.c(OH-)>c(HF)>c(CH3COOH)>c(H+) | B.c(OH-)>c(F-)>c(CH3COO-)>c(H+) |
| C.c(F-)+ c(CH3COO-)="2" c(Na+) | D.c(HF)+c(CH3COOH)+ c(H+)=c(OH-) |