氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 + 3 C 高温 2AlN + 3CO,下列叙述正确的是
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中每生成2 mol AlN,N2得到3 mol电子 |
| C.氮化铝中氮元素的化合价为-3价 |
| D.氮化铝晶体属于分子晶体 |
13.部分弱酸的电离平衡常数如下表:
下列说法正确的是
A.0.1 mol·L-l NaHCO3溶液中各离子浓度的大小顺序为:c(Na+) c(HCO c(HCO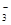 )>c(H+) )>c(H+) c(OH-) c(OH-) |
B.少量的CO2通人到NaCN溶液中: CN-+H2 O+CO2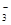 |
| C.用0.1 mol·L-l NaOH溶液中和等浓度的HCN溶液和HCOOH溶液时,前者所需NaOH溶液体积大 |
| D.相同体积的0.1 mol·L-l HCOONa溶液比0.1 mol·L-l NaCN溶液所含离子总数小 |
12.物质的量浓度相同的下列溶液:①Na2 CO3;②NaHCO3;③H2 CO3;
④(NH4)2 CO3;⑤NH4 HCO3,按c(CO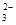 )由小到大排列顺序正确的是
)由小到大排列顺序正确的是
A.⑤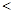 ④ ④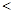 ③ ③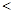 ② ②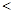 ① ① |
B.③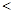 ⑤ ⑤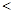 ② ②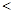 ④ ④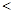 ① ① |
C.③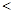 ② ②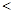 ⑤ ⑤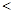 ④ ④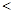 ① ① |
D.③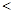 ⑤ ⑤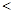 ④ ④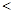 ② ②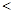 ① ① |
11.NA代表阿伏加德罗常数的值,下列说法正确的是
| A.1 mol FeCl3完全水解生成NA个胶体粒子 |
| B.常温常压下,23 g NO2放置一段时间后分子总数小于0.5NA |
| C.标准状况下,2.24 L CCl4中含有的C-Cl键数为0.4NA |
| D.6.8 g熔融态KHSO4.中含有0.1NA个阳离子 |
10.下列各组离子中,能在指定溶液中大量共存的是
①无色溶液中:K+、Cl-、Na+、HCO 、OH-
、OH-
②使pH试纸变深蓝色的溶液中:K+、CO 、Na+、AlO
、Na+、AlO
③由水电离出的c(H+)=10-12 mol·L-l的溶液中:ClO-、HCO 、NO
、NO 、NH
、NH
④加入Mg能放出H2的溶液中:Mg2+、NH 、Cl-、Na+、SO
、Cl-、Na+、SO
⑤使甲基橙变红的溶液中:MnO 、NO
、NO 、SO
、SO 、Na+、Fe3+
、Na+、Fe3+
⑥pH=0的溶液中:Fe2+、Al3+、NO .Cl-、SO
.Cl-、SO
| A.①③ | B.②④⑤ | C.①②⑤ | D.③⑥ |
9.下列实验现象及相关的离子方程式均正确的是
| A.Cl2与FeI2溶液反应,当n(C12):n(FeI2)=1:1时:2Fe2++2I-+2C12 |
| B.向Ba(NO3)2溶液中通人SO2气体,出现白色沉淀:Ba2++SO2+ H2O |
| C.向H2O2溶液中滴加酸化的KMnO4溶液,KMnO4溶液褪色:2 MnO4+7 H2 O2+6 H+ |
D.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合:Ba2++SO +H++OH- +H++OH- |