元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是( )
| A.元素原子的最外层电子数等于元素的最高化合价 |
| B.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| C.P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强 |
| D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
某温度下,有反应H2(g)+I2(g)  2HI(g);正反应为放热反应,在带有活塞的密闭容器中达到平衡。下列说法中正确的是( )
2HI(g);正反应为放热反应,在带有活塞的密闭容器中达到平衡。下列说法中正确的是( )
| A.体积不变,升温,正反应速率减小 |
| B.温度、压强均不变,充入HI气体,开始时正反应速率增大 |
| C.温度不变,压缩气体的体积,平衡不移动,颜色加深 |
| D.体积、温度不变,充入氮气后,正反应速率将增大 |
可逆反应2A(g)+3B(g)  2C(g)+D(g)在四种不同条件下的反应速率分别为:①v(A)=0.5 mol/(L·min) ②v(B)=0.6 mol/(L·min) ③v(C)=0.35 mol/(L·min)④v(D)=0.4 mol/(L·min)。则该反应在不同条件下反应速率最快的是( )
2C(g)+D(g)在四种不同条件下的反应速率分别为:①v(A)=0.5 mol/(L·min) ②v(B)=0.6 mol/(L·min) ③v(C)=0.35 mol/(L·min)④v(D)=0.4 mol/(L·min)。则该反应在不同条件下反应速率最快的是( )
A.① B.② C.③D.④
在某一化学反应中,反应物A的浓度在15 s内从3.0 mol/L变成1.5 mol/L,
在这15 s内A的化学反应速率为( )
| A.1.5 mol/(L·s) | B.1.5 mol/L |
| C.0.1 mol/(L·s) | D.0.1 mol/L |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反
应原理是 ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=" +" 49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol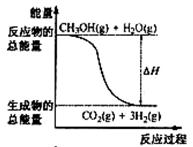
下列说法正确的是()
| A.CH3OH的燃烧热为192.9 kJ/mol |
| B.反应①中的能量变化如右图所示 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
| D.根据②推知:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g) ΔH > -192.9kJ/mol |
管道煤气的主要成分是H2、CO和少量的甲烷。相应的热化学反应方程式为:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/mol
CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890.3 kJ/mol
当使用管道煤气的用户改用天然气后,在相同条件下燃烧等体积的天然气,
理论上所获得的热值,前者大约是后者的多少倍()
| A.0.8 | B.1.3 | C.3.1 | D.0.32 |