已知向氯酸钠的酸性水溶液中通入二氧化硫气体,反应中SO2氧化过程为:SO2+2H2O–2 e—==SO42—+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,反应中还原过程为:Cl2 + 2 e— ==2Cl—。在上述两个反应中均会生成产物X,则X的化学式为( )
| A.ClO2 | B.NaClO4 | C.HClO | D.NaClO |
下列关于强、弱电解质的叙述,有错误的是()
| A.强电解质在溶液中完全电离,不存在电离平衡 |
| B.在溶液中,导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质 |
| C.强电解质都是离子化合物,弱电解质都是共价化合物 |
| D.纯净的强电解质在液态时,有的导电,有的不导电 |
工业生产水煤气的反应为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.4 kJ/mol,下列判断正确的是()
| A.反应物能量总和小于生成物能量总和 |
| B.CO(g)+H2(g)=C(s)+H2O(g) ΔH=+131.4 kJ/mol |
| C.水煤气反应中,生成1 mol H2(g)吸收131.4 kJ热量 |
| D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 |
已知下列反应的热化学方程式为
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+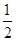 O2(g)=H2O(l) ΔH3=-285.8 kJ/mol
O2(g)=H2O(l) ΔH3=-285.8 kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH为()
| A.-488.3 kJ/mol | B.-191 kJ/mol | C.-476.8 kJ/mol | D.-1 549.6 kJ/mol |
在一定条件下,已达平衡的可逆反应:2A(g)+B(g)  2C(g),下列说法中正确的是()
2C(g),下列说法中正确的是()
A.平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=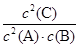 |
| B.改变条件后,该反应的平衡常数K一定不变 |
| C.如果改变压强并加入催化剂,平衡常数会随之变化 |
| D.若平衡时增加A和B的浓度,则平衡常数会减小 |
制取水煤气的反应为C(s)+H2O(g)  CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是
CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是
| A.加压 | B.升温 |
| C.增大水蒸气浓度 | D.增大碳的物质的量 |