2.8g Fe全部溶于一定浓度、200mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是( )
| A.反应后溶液中存在Fe3+和Fe2+ | B.1.12L气体是NO、NO2的混合气体 |
| C.反应后溶液中c(NO3-)=0.85mol·L-1 | D.反应后的溶液最多还能溶解1.4gFe |
下列关于乙酸和乙醇说法正确的是
| A.都难溶于水 | B.都能使石蕊试液变红 |
| C.都能与钠反应 | D.相互间不能发生反应 |
化学实验有助于理解化学知识,形成化学观念。下列实验操作正确的是
对于合成氨反应:N2(g) +3H2(g) 2NH3(g)的有关说法正确的是
2NH3(g)的有关说法正确的是
| A.加热能减小反应速率 | B.使用催化剂能加大反应速率 |
| C.减小压强能加大反应速率 | D.反应达到平衡时,v(正)=v(逆)=0 |
日本福岛核污水泄漏事件持续受到广泛关注,福岛附近海域及地下水受到高浓度放射
性锶-89和锶-90污染,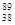 Sr和
Sr和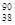 Sr核素具有相同的
Sr核素具有相同的
| A.电子数 | B.质量数 | C.中子数 | D.相对原子质量 |
某溶液中存在较多的Na+、H+、C1-,溶液中还可能大量存在的离子是
| A.OH- | B.Ag+ | C.NH4+ | D.CO32- |