(6分)氮气其化合物是中学化学的基础知识,请你回答下列含氮化合物的有关问题。
(1)汽车尾气中含有氮氧化物,严重污染大气。NO和NO2是常见的氮氧化物,这两种氮氧化物中,呈红棕色的是 ;
(2)一氧化氮在常温下很容易与空气中的氧气化合,生成二氧化氮。该反应的化
学方程式为: ;
(3)实验室常用NH3做“喷泉实验”,该实验说明NH3的溶解性是 溶于水(填“极易”或“极难”)。
氧氮杂 是新药研制过程中发现的一类重要活性物质,具有抗惊厥、抗肿瘤、改善脑缺血等性质。下面是某研究小组提出的一种氧氮杂
是新药研制过程中发现的一类重要活性物质,具有抗惊厥、抗肿瘤、改善脑缺血等性质。下面是某研究小组提出的一种氧氮杂 类化合物H的合成路线:
类化合物H的合成路线:
(1)原料A的同分异构体中,含有苯环、且核磁共振氢谱中有4个峰的是 (写出其结构简式)。
(2)反应②的化学方程式是_________________。
(3)③的反应类型是___________。原料D中含有的官能团名称是_________、_________。
(4)原料B俗名“马莱酐”,它是马莱酸(顺丁烯二酸: )的酸酐,
)的酸酐,
它可以经下列变化分别得到苹果酸( )和聚合物Q:
)和聚合物Q:
写出反应I和反应II的化学方程式:___________________、_____________________。
(5)符合下列条件的中间产物F的同分异构体数目是________(不考虑手性异构),写出其中任意一种的结构简式___________。
(i) 能发生银镜反应;
(ii) 分子中含有三取代的苯环结构,其中两个取代基是:—COOCH3和 ,且二者处于对位。
,且二者处于对位。
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
从废料中回收氧化钴(CoO)的工艺流程如下:
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根)。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_______________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式____________________。
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是__________。
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是______(填序号)。
| A.c(Na+) = 2c(CO32-) |
| B.c(Na+) > c(CO32-) > c(HCO3-) |
| C.c(OH-) > c(HCO3-) > c(H+) |
| D.c(OH-) - c(H+) = c(HCO3-) + 2c(H2CO3) |
(6)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是______。
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
① 浓盐酸在反应中显示出来的性质是_______(填序号)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
② 若上述反应中产生0.1 mol ClO2,则转移电子的物质的量为_______mol。
(2)目前已开发出用电解法制取ClO2的新工艺。
①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式:__________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol;用平衡移动原理解释阴极区pH增大的原因______________。
(3)ClO2对污水中Fe2+、Mn2+、S2—和CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为_______;处理100 m3这种污水,至少需要ClO2 _______ mol 。
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大。有关信息如下表:
| X |
动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y |
地壳中含量居第一位 |
| Z |
短周期中其原子半径最大 |
| Q |
生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M |
海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
(1)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,请写出该气态氢化物的电子式____________。
(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族。下列有关说法正确的是____________(填序号)。
A.原子半径: Rb>I
B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(3)化合物QX导热性好,热膨胀系数小,是良好的耐热冲击材料。抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料。有关化合物QX的制备及化学性质如下(所有热量数据均已折合为25℃、101.3 kPa条件下的数值)
可用Q和X的单质在800 ~ 1000℃制得,每生成1 mol QX,吸收a kJ的热量。
可用Q的氧化物、焦炭和X的单质在1600 ~ 1750℃生成QX,每生成1 mol QX,消耗18 g碳,吸收b kJ的热量。
请根据上述信息写出在理论上Q的氧化物跟焦炭反应生成Q单质和CO的热化学方程式________________。
(4)X、Y组成的一种无色气体遇空气变为红棕色。将标准状况下40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐。请写出该反应的离子方程式。
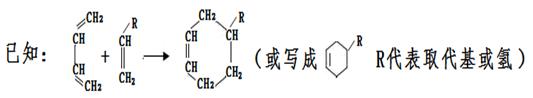
以烯烃为原料,合成某些高聚物的路线如下: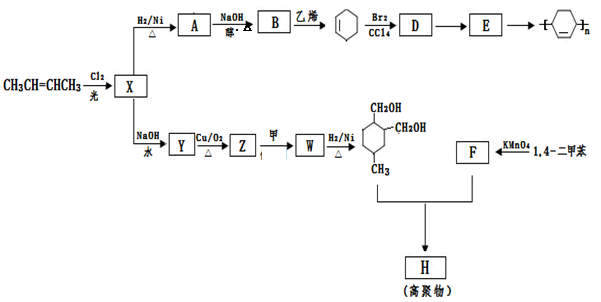
(1)CH3CH=CHCH3的名称是。
(2)X中含有的官能团是。
(3)A→B的化学方程式是。
(4)D→E的反应类型是。
(5)甲为烃,F能与NaHCO3反应产生CO2。
① 下列有关说法正确的是。
a.有机物Z能发生银镜反应 b.有机物Y与HOCH2CH2OH 互为同系物
c.有机物Y的沸点比B低 d.有机物F能与己二胺缩聚成聚合物
② Y的同分异构体有多种,写出分子结构中含有酯基的所有同分异构体的结构简式。
③ Z→W的化学方程式是。
(6)高聚物H的结构简式是。