用足量的CO还原7.52g某铁氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为12.0g,则此铁氧化物的化学式是
| A.FeO | B.Fe2O3 | C.Fe3O4 | D.Fe5O6 |
将足量的CO2慢慢通入一定体积的NaOH溶液中,溶液的pH随CO2的体积(已经折算成标准状况)的变化曲线如图所示(不考虑过量的CO2在水中的溶解和反应过程中溶液体积的变化),则下列说法不正确的是()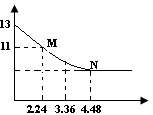
| A.NaOH溶液的物质的量浓度为0.1mol/L |
| B.NaOH溶液的体积为2L |
| C.M点离子浓度的大小关系满足c(HCO3-)>c(CO32-) |
| D.M、N点对应的纵坐标均大于7 |
短周期元素X、Y、Z、R、W五种元素原子序数依次增大,其中X与Z、Y与W分别为同族元素。原子半径X<Y< W< R<Z,W原子的最外层电子数比内层电子总数少4,Z、R的核外电子数之和与Y、W核外电子数之和相等。下列说法不正确的是()
| A.Y、Z、R的简单离子具有相同的电子层结构 |
| B.X2Y分子间存在氢键,故X2Y比X2W稳定 |
| C.X、Z分别与Y均可形成A2B与A2B2型化合物,且A2B2均有较强的氧化性 |
| D.由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生复分解反应 |
归纳总结是学习与研究化学行之有效的方法,某同学在全面复习的基础上作出如下归纳:
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3
②给出质子能力:CH3COOH>CH3CH2OH>H2O
③相同物质的量浓度溶液中c(NH4+):(NH4)2SO4>(NH4)2CO3>NH4Cl
④微粒半径:r(H+)>r(H)>r(H-)
⑤熔沸点:H2O > H2S > H2Se
⑥不活泼金属单质一定不能与活泼金属盐溶液反应
以上归纳中正确的是()
| A.①② | B.③④ | C.①③ | D.②⑥ |
已知可用Co2O3代替MnO2制备Cl2,反应前后存在六种微粒:Co2O3、H2O、Cl2、H+、Cl-和Co2+.下列叙述不正确的是()
A.氧化产物为Cl2 |
B.氧化剂与还原剂的物质的量之比为1:6 |
C.若有3molH2O生成,则反应中有2mol电子转移 |
D.微粒的还原性Cl- > Co2+ |
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如右图所示。则下列说法中正确的是()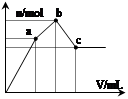
| A.a点的溶液呈中性 |
| B.b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH- = Al(OH)3↓+2BaSO4↓ |
| C.c点加入Ba(OH)2溶液的体积为200 mL |
| D.c点溶液呈碱性 |