人的纯净胃液是一种无色液体,呈酸性,PH在0.9~1.5之间,其中H+的浓度比血液中高几万倍,回答下列问题:
①胃液有帮助人体消化食物等多种功能,胃酸的主要成份是
②若胃酸酸度增大就会患胃酸过多症,下列物质不宜用做治疗胃酸过多的药物是
A、小苏打 B氢氧化铝 C、氢氧化钠 D、碳酸镁
③胃舒平的主要成份是氢氧化铝,不溶于水且作用持久,写出该药物中和胃酸的离子方程式 。
下列有机化合物中,有的有多个官能团:
(1)可以看作醇类的是(填入编号)
(2)可以看作酚类的是
(3)可以看出羧酸类的是
(4)可以看出酯类的是
表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅧA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
(1)证明⑨的非金属性比⑧强的实验事实是;
②的单质与③、⑧的最高价氧化物对应水化物的浓溶液都能发生反应,与⑧反应的化学方程式为。
(2)现有Z、W两种中学化学中的常见物质,它们由①、③、④中的两种或三种元素组成。Z的浓溶液常温下能使铁钝化,由此可知Z的化学式为;W中①、③两种元素的质量比为3:14,写出W的电子式;W与④的单质在催化剂、加热条件下发生的反应是工业制取Z的基础,写出该反应的化学方程式:。
(3)电动汽车的某种燃料电池,通常用NaOH作电解质,用⑥的单质、石墨作电极,在石墨电极一侧通入空气,该电池负极的电极反应。
⑧的一种氧化物,通常情况为气体,是形成酸雨的主要原因之一,可利用某种燃料电池,通常用硫酸溶液作电解质,用石墨作电极,在一端通入空气,另一端通入该气体,该电池负极的电极反应。该燃料电池的产物为。
个化学反应,我们不但关心物质变化和能量变化,还通常要研究化学反应的快慢
(1)用纯净的锌粒和盐酸反应制取氢气,回答:
实验过程如下图所示,分析判断:________段化学反应速率最快,原因是,_______段收集的氢气最多。
为了加快上述反应的速率,欲向溶液中加入一定量下列物质,你认为可行的是
A.胆矾晶体 B.硫酸氢钠固体
C.氯化锌浓溶液 D.浓硝酸
除了上述方法外,你认为还可以采取措施来加快化学反应速率。
(2)下图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。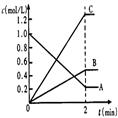
试回答
①该反应的化学方程式为_________________________________。
②达到平衡状态的所需时间是2min,A物质的平均化学反应速率为____________
氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用。
(1)请在下图的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在)。
(2)从能量转换的角度看,过程Ⅱ应是_________能转化为_________能。
(3)该燃料电池中以KOH溶液作电解质溶液,请写出该电池的电极反应式:
负极____________________________________;
正极____________________________________。
该燃料电池的优点为
列几组物质中,互为同位素的有__________,互为同素异形体(同一种元素形成的不同的单质)的有________,互为同系物的有____________,互为同分异构体的有____________________,属于同种物质的有__________。
①O2和O3 ②35Cl和37Cl ③CH3CH3和CH3CH2CH3④CH3CH2CH(CH3)CH2CH3和
CH3CH2CH(CH3)CH(CH3)CH3
⑤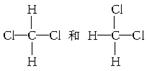
⑥CH3(CH2)2CH3和(CH3)2CHCH3⑦CH3CH(CH3)CH3和CH(CH3)3