已知:
(1)Zn(s)+1/2O2(g) = ZnO(s) △H =-348.3 kJ/mol (2) 2Ag(s)+1/2O2(g) = Ag2O(s) △H =-31.0 kJ/mol
(2) 2Ag(s)+1/2O2(g) = Ag2O(s) △H =-31.0 kJ/mol 则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的△H等于( )
则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的△H等于( )
| A.-317.3 kJ/mol | B.-379.3 kJ/mol |
| C.-332.8 kJ/mol | D.317.3 kJ/mol |
已知A物质的分子结构简式如下: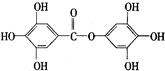 , lmol A与足量的NaOH溶液混合共热,充分反应后最多消耗NaOH的物质的量为( )
, lmol A与足量的NaOH溶液混合共热,充分反应后最多消耗NaOH的物质的量为( )
| A.6mol | B.7mol | C.8mo1 | D.9mo1 |
为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是()
| 被提纯物质 |
除杂试剂 |
分离方法 |
|
| A |
苯(苯甲酸) |
生石灰 |
蒸馏 |
| B |
乙醇(乙酸) |
氢氧化钠溶液 |
分液 |
| C |
乙烷(乙烯) |
酸性高锰酸钾溶液 |
洗气 |
| D |
苯(苯酚) |
浓溴水 |
过滤 |
化合物A(C4H8Br2)可由下列反应制得,
C4H10O C4H8
C4H8 C4H8Br2,则结构式不可能的是 ()
C4H8Br2,则结构式不可能的是 ()
| A.CH3CH2CHBrCH2Br | B.CH3CHBrCHBrCH3 |
| C.CH3CH(CH2Br)2 | D.(CH3)2CBrCH2Br |
由两种烃组成的混合气体2L与足量的氧气充分反应后生成CO2 5L、H2O 7L(所有体积都在120℃测定),则这两种混合气体的可能组成是()
| A.C2H4、C3H8 | B.C2H6、C3H8 |
| C.CH4、C4H8 | D.CH4、C5H8 |
下列有关实验的说法中错误的是()
| A.在蒸馏的实验中,温度计的水银球位于支管口处是为了测出馏分的沸点 |
| B.可用四氯化碳萃取溴水中的溴 |
| C.在重结晶的实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失 |
| D.作为重结晶实验的溶剂,杂质在此溶剂中的溶解度受温度影响应该很大 |