在一定温度下,向密闭容器中充入1.0molN2和3.0molH2,反应达到平衡时测得NH3的物质的量为0.6mol。若在该容器中开始时充入2.0 molN2和6.0molH2,则平衡时NH3的物质的量为
| A.若为定容容器,n(NH3)=1.2mol | B.若为定压容器,n(NH3) >1.2mol |
| C.若为定容容器,n(NH3)>1.2mol | D.若为定压容器,n(NH3)<1.2mol |
关于如图所示的原电池,下列说法正确的是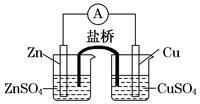
| A.电子从铜电极通过检流计流向锌电极 |
| B.盐桥中的阳离子向硫酸铜溶液中迁移 |
| C.锌电极发生还原反应,铜电极发生氧化反应 |
| D.铜电极上发生的电极反应是2H++2e-===H2↑ |
已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol·L-1的NaA和NaB混合溶液中,下列排序正确的是
A.c(OH-)>c(HA)>c(HB)>c(H+)B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+) D.c(OH-)>c(HB)>c(HA)>c(H+)
铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4,工作时的反应为
Pb+PbO2+2H2SO4=2PbSO4+2H2O,下列结论正确的是
| A.Pb 为正极被氧化 |
| B.溶液的pH不断减小 |
| C.放电时负极反应式是PbO2 +4H++ SO42-+2e-= PbSO4 +2H2O |
| D.溶液pH不断增大 |
用惰性电极电解饱和Na2CO3溶液,若保持温度不变,则一段时间后
| A.溶液的pH变大 | B.c(Na+)与c(CO32-)的比值变大 |
| C.溶液浓度变大,有晶体析出 | D.溶液浓度不变,有晶体析出 |
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,b上产生大量气泡。则四种金属的活动性顺序由强到弱的是
| A.a>b>c>d | B.a>c>d>b | C.c>a>b>d | D.b>d>c>a |