如图是某同学设计的放热反应的观察装置。
其实验顺序是:①按图所示将实验装置连接好。
②在U形管内加入少量红墨水(或品红)溶液。打开T型管螺旋夹,使U形管内两边的液面处于同一水平面,再夹紧螺旋夹。
③在中间的试管里盛1 g氧化钙,当滴入2 mL左右的蒸馏水后,同时打开螺旋夹即可观察。
试回答:
(1)实验中观察到的现象是 。
(2)该实验中在安装好装置后必须进行的第一步实验操作是 。
(3)实验中反应的化学反应方程式是 。
(4)说明CaO、H2O的能量之和 Ca(OH)2的能量。(填“>”、“<”或“=”)
(5)若该实验中CaO换成NaCl,实验还能否观察到相同现象? 。
铁是一种历史悠久、应用最广泛、用量最大的金属。有三位同学分别用铁粉
进行如下探究实验:
(1)甲同学用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:
①步骤②中,除发生反应Fe+2HClFeCl2+H2↑外,其他可能反应的离子方程式
为:。
②可以验证溶液B中是否含有Fe2+的一种试剂是(填选项序号)
a.稀硫酸 b.铁 c.硫氰化钾 d.酸性高锰酸钾溶液
(2)乙同学欲用少量Fe粉与足量浓硫酸反应得到硫酸亚铁。有人认为不论常温还是加热的条件下均不可行,理由是
于是乙同学将上述方案做如下改进后可获得FeSO4·7H2O,请填写下列括号中的空白: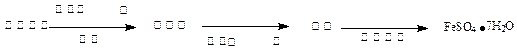 (3)丙同学为测试一铁片中铁元素的含量,在实验室中用m g铁片完全溶解于过量稀硫酸中,准确测定出反应生成氢气的体积为V mL (已折算成标准状况),则该铁片中铁的质量分数为(用含m、V的代数式表示) 。若排除实验仪器和操作的影响因素,试对上述方案测定结果的准确性做出判断和分析:方案 (填“准确”“不准确”“不一定准确”),理由是
(3)丙同学为测试一铁片中铁元素的含量,在实验室中用m g铁片完全溶解于过量稀硫酸中,准确测定出反应生成氢气的体积为V mL (已折算成标准状况),则该铁片中铁的质量分数为(用含m、V的代数式表示) 。若排除实验仪器和操作的影响因素,试对上述方案测定结果的准确性做出判断和分析:方案 (填“准确”“不准确”“不一定准确”),理由是
.
实验室需要0.80 mol/L NaOH溶液475 mL和0.40 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题: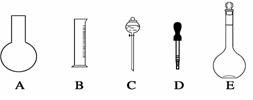
(1)如图所示的仪器中配制溶液肯定不需要的是(填序号),配制上述溶液还需用到的玻璃仪器是(填仪器名称)。
(2)根据计算用托盘天平称取NaOH的质量为g。在实验中其他操作均正确,若定容时俯视视刻度线,则所得溶液浓度0.8 mol/L(填“大于”、“等于”或“小于”,下同)。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度0.8 mol/L。
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为mL
某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题: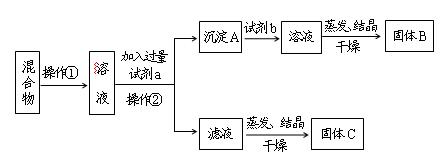
(1)操作①的名称是,操作②的名称是。
(2)试剂a是,试剂b是,固体B是。(填化学式)
(3)加入试剂a所发生的离子方程式为:。
加入试剂b所发生的离子方程式为:。
化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。某研究性学习小组用如下图装置进行铜与浓硫酸反应的实验研究。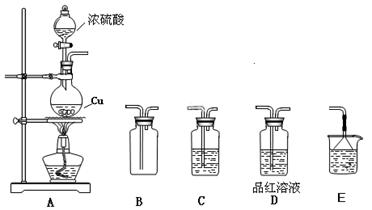
(1)装置A中发生反应的化学方程式;
(2)若要使B 中收集满干燥的SO2气体(并证实B中已收集满),则上述装置的连接顺序为:接接接接(用字母表示);
(3)C 中盛放的试剂是,证明B 中已收集满SO2的现象是;
(4)待烧瓶中充分反应后,同学们发现铜有剩余,经检测发现硫酸也有剩余。检验硫酸有剩余的方法是___________________;
(5)在不补充浓硫酸的前提下,为使铜进一步溶解,可向烧瓶中加入 ________(填序号)。① 盐酸 ② FeSO4 ③ Fe2O3 ④KNO3
实验室制乙烯通常采用乙醇与浓硫酸(体积比为1:3)混合加热到170℃制得,反应过程中乙醇常被炭化,溶液中有黑色物质出现,随着反应进行炭化现象越来越严重,同时制得的乙烯气体中通常会含有CO2、SO2等气体,为确认混合气体中含有乙烯和二氧化硫,可让混合气体依次通过下图实验装置。(可供选择的试剂:品红溶液、氢氧化钠溶液、溴水、酸性高锰酸钾溶液、浓硫酸,试剂可重复使用。)
A.①②中盛放的试剂分别为①;②;(填试剂名称)
B.能说明二氧化硫气体存在的现象是。
C.能确认含有乙烯的现象是。