进行化学实验,观测实验现象,通过分析推理得出正确的结论是化学学习的方法之一。下列对有关实验事实的解释正确的是( )
| A.SO2气体通入溴水(橙红色)褪色,表现了SO2的漂白性;足量的二氧化硫通入紫色石蕊试液中先变红后褪色,因为生成酸使其变红,又因为SO2的漂白性,使其褪色。 |
| B.浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸 |
| C.常温下,将铝片放入浓硫酸中,无明显现象,说明铝不与冷的浓硫酸反应 |
| D.向CuSO4溶液中加入一小块金属钠,则钠与Cu2+反应可置换出铜 |
下列说法不正确的是()
| A.物质发生化学反应的反应热仅指反应放出的热量 |
| B.热化学方程式中各物质的化学计量数只表示物质的量,不表示分子的个数 |
| C.所有的燃烧都是放热反应 |
| D.热化学方程式中分子式前面的化学计量数可以是分数 |
下列变化,属于吸热过程的是()
| A.浓H2SO4溶于水 | B.甲烷燃烧 |
| C.CaO与水反应 | D.Ba(OH)2晶体与NH4Cl反应 |
下列说法中不正确的是()
| A.化石燃料在任何条件下都能充分燃烧 |
| B.化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体 |
| C.直接燃烧煤不如将煤进行深加工后,再燃烧效果好 |
| D.固体煤变为气体燃料后,燃烧效率将更低 |
已知下列热化学方程式
Zn(s)+ 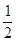 O2(g)====ZnO(s) ΔH1="-351.1" kJ·mol-1
O2(g)====ZnO(s) ΔH1="-351.1" kJ·mol-1
Hg(l)+ 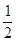 O2(g) ====HgO(s) ΔH2="-90.7" kJ·mol-1
O2(g) ====HgO(s) ΔH2="-90.7" kJ·mol-1
由此可知Zn(s)+HgO(s) ====ZnO(s)+Hg(l) ΔH3。其中ΔH3的值是()
| A.-441.8 kJ·mol-1 | B.-254.6 kJ·mol-1 |
| C.-438.9 kJ·mol-1 | D.-260.4 kJ·mol-1 |
下列热化学方程式书写正确的是()
A.2SO2+O2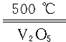 2SO3 ΔH="-196.6" kJ·mol-1 2SO3 ΔH="-196.6" kJ·mol-1 |
B.H2(g)+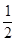 O2(g)====H2O(l) ΔH="-285.8" kJ·mol-1 O2(g)====H2O(l) ΔH="-285.8" kJ·mol-1 |
| C.2H2(g)+O2(g) ====2H2O(l) ΔH="-571.6" kJ |
| D.C(s)+O2(g) ====CO2(g) ΔH="+393.5" kJ·mol-1 |