在密闭容器中,将1.0 mol CO与1.0 mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g) CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol。则下列说法正确的是
CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol。则下列说法正确的是
| A.800℃下,该反应的化学平衡常数为0.25 |
| B.427℃时该反应的平衡常数为9.4,则该反应的△H<0 |
| C.800℃下,若继续向该平衡体系中通入1.0 mol的CO(g),则平衡时CO物质的量分数为33.3% |
| D.800℃下,若继续向该平衡体系中通入1.0 mol的H2O(g),则平衡时CO转化率为66.7% |
对物质进行分类是一种简单、有效的科学方法。下列各组物质的分类都正确的是()
| A.空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质) |
| B.NO2(酸性氧化物)、CH3CHO(有机物)、CO(无机物)、CH3COOCH3(酯) |
| C.HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(氧化物)、CH3I(卤代烃) |
| D.液氨(氢化物)、NH4C1(铵盐)、HNO3(含氧酸)、冰水(混合物) |
在日常生活中,下列解决问题的方法不可行的是()
| A.为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土 |
| B.为加快漂白精的漂白速率,使用时可滴加几滴醋酸 |
| C.“地沟油”禁止食用,但处理后可用来制肥皂和生物柴油 |
| D.为防止海鲜腐烂,可将海鲜产品浸泡在硫酸铜溶液中 |
炼铁的还原剂CO是由焦炭和CO2反应而得。现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)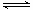 2CO(g)△H=QkJ/mol。下图为CO2、CO的物质的量n随时间t的变化关系图。下列说法正确的是()
2CO(g)△H=QkJ/mol。下图为CO2、CO的物质的量n随时间t的变化关系图。下列说法正确的是()
| A.0~1min,v(CO2)=1mol/(L·min) |
B.当容器内的压强不变时,反应一定达到平衡状态且 <1 <1 |
| C.3min时温度由T1升高到T2,则可以判断Q>0 |
| D.5min时再充入一定量的CO,n(CO)、n(CO2)的变化可分别由a、b曲线表示 |
下图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是()
| A.该过程是电能转化为化学能的过程 |
| B.铜电极的电极反应式为:CO2+8H++8e-=CH4+2H2O |
| C.一段时间后,①池中n(KHCO3)不变 |
| D.一段时间后,②池中溶液的pH一定下降 |
室温下,对于醋酸及其盐的下列判断正确的是()
| A.稀醋酸溶解石灰石的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑ |
| B.稀醋酸加水稀释后,溶液中c(CH3COO-)/c(CH3COOH)变大 |
C.向稀醋酸中加入等浓度的NaOH溶液,导电能力变化如下图 |
| D.CH3COONH4溶液和K2SO4溶液均显中性,两溶液中水的电离程度相同 |