如图所示,夹子开始处于关闭状态,将液体A滴入烧瓶与气体B充分反应,打开夹子,可发现试管内的水立刻沸腾了,则液体A和气体B的组合不可能是
| A.水、氯化氢 |
| B.硫酸、氨气 |
| C.氢氧化钠溶液、二氧化硫 |
| D.氢氧化钠溶液、一氧化碳 |
下列各变化中属于原电池的反应的是
| A.在空气中金属铝表面迅速氧化形成保护层 |
| B.从海水中通过化学方法得到金属镁 |
| C.红热的铁丝与冷水接触,表面表成蓝黑色保护层 |
| D.锌和稀硫酸反应时,加入少量的CuSO4溶液可使反应加快 |
在一定温度下某密闭容器中,可逆反应A(g)+3B(g)  2C(g)+2D(s)达到平衡,下列描述一定正确的是
2C(g)+2D(s)达到平衡,下列描述一定正确的是
①C的生成速率与C的分解速率相等 ②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化 ④反应物的转化率不再变化
⑤混合气体的压强不再变化 ⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB ⑧A、B、C、D的分子数之比为1:3:2:2
A. ①②③④⑤⑥⑦ B.①③④⑤⑥⑦
C.①③④⑥⑦D.①③⑤⑥⑦⑧
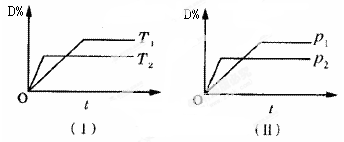
对于可逆反应mA(g)+nB(s) pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强p的关系如图所示,请判断下列说法正确的是
pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强p的关系如图所示,请判断下列说法正确的是
| A.降温,化学平衡向正反应方向移动 |
| B.使用催化剂可使D%有所增加 |
| C.化学方程式中气体的化学计量数m>p+q |
| D.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动 |
下列叙述中,能证明某物质是强电解质或弱电解质的是
| A.某物质熔化时不导电,则该物质为弱电解质 |
| B.某物质不是离子化合物,而是极性共价化合物,则该物质为弱电解质 |
| C.某一元酸2 mol与足量Zn完全反应生成1 molH2,则该酸为强酸 |
| D.溶液中已电离的离子和未电离的分子共存,则该物质为弱电解质 |
下列有关叙述中正确的是
| A.难溶于水的电解质一定是弱电解质 |
| B.强电解质在水溶液中的电离过程是不可逆的 |
| C.易溶于水的电解质一定是强电解质 |
| D.强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强 |