(11分)已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素。
⑴ W在周期表中的位置: 。
⑵在一定条件下,容积为1L密闭容器中加入1.2molX2和0.4molY2,发生如下反应:
3X2 (g) + Y2(g)  2YX3(g) △H 反应各物质的量浓度随时间变化如下:
2YX3(g) △H 反应各物质的量浓度随时间变化如下:
①此反应的平衡常数表达式为 (用化学式表示) , K= 。
②若升高温度平衡常数K减小,则△H 0(填>,<)。
⑶A1是四种元素中三种元素组成的电解质,溶液呈碱性,将0.1mol·L-1的A1溶液稀释至原体积的10倍后溶液的pH=12,则A1的电子式为 。
⑷B1、B2是由四种元素三种形成的强电解质,且溶液呈酸性,相同浓度时B1溶液中水的电离程度小于B2溶液中水的电离程度,其原因是 。
⑸A2和B1反应生成B2,则0.2mol/LA2和0.1mol/L B1等体积混合后溶液中离子浓度大小关系为 。
已知下列反应 :
H2(g)=2H(g)ΔH1=+Q1 kJ/mol
O2(g)=2O(g)ΔH2=+Q2 kJ/mol
2H(g)+O(g)=H2O(g)ΔH3=-Q3 kJ/mol
H2O(g)=H2O(l)ΔH4=-Q4 kJ/mol
H2(g)+ 1/2O2(g)=H2O(l);ΔH5=-Q5 kJ/mol
试指出Q1、Q2、Q3、Q4、Q5的等量关系:
某不可逆反应的反应进程的能量变化如图所示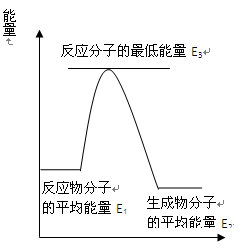
(1)该反应是热反应,反应热ΔH0
(2)反应的活化能为
(3)对反应体系加热,提高了活化分子数增多,反应速率加快;在反应体系中加入催化剂,降低了活化分子数增多,反应速率大大地加快。(2、3两问用E1、E2、填空)
热化学方程式:2H2(g)+O2(g)=2H2O(I) △H= -571.6kJ/mol表示的意义是
H2(g)+1/2O2(g)=H2O(l)△H=
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。
(1)由图中的数据分析,该反应的化学方程式为
(2)反应开始至2min、5minZ的平均反应速率为、;
(3)5min后Z的生成速率比5min末Z的生成速率(大、小、相等)。
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快。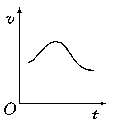
(1)反应开始进行时,反应速率加快的原因是(要求写出化学方程式)
;
(2)反应后期,反应速率下降的原因是
。