同学们在实验室发现了三种金属—铝、铁、铜,其中有一块铜片生锈了,表面附有部分铜绿(铜绿的主要成分是Cu2(OH)2CO3 ).他们的实验过程如下:
(1)铜绿是铜与空气中的氧气、水和 (填化学式)共同作用的结果。
(2)为探究铝、铁、铜的活动性顺序,某同学设计了一组实验:①铝片浸入稀硫酸中:②铜片浸入稀硫酸中;③铝片浸入氯化亚铁溶液中,这组实验还不能完全证明三种金属的活动性顺序。请你补充一个实验来达到实验目的(写出实验步骤,现象)
(3)他们还想用加热的方法除去铜绿,加热时却发现铜片表面全部变黑。经查阅资料知道:①铜绿受热分解会生成黑色的氧化铜 ②酒精在不完全燃烧时会生成炭黑 ③炭黑与稀硫酸不反应。
a他们提出猜想:该黑色物质可能是氧化铜,也可能是氧化铜和 的混合物。
b设计了下述实验方案,用于检验黑色物质。
| 实验步骤 |
实验现象 |
结论 |
| 剪下一片变黑的铜片,放入盛有足量稀硫酸的试管中,微热 |
铜片表面黑色固体全部消失,露出红色的铜,溶液变 色 |
此黑色固体是 (填化学式) |
写出下列化学反应的符号表达式,并在括号内注明基本反应类型:
(1)铁丝在氧气中燃烧 ()
(2)用氯酸钾和二氧化锰制取氧气
请用恰当的化学符号和数字填空:
(1)找规律填空:①O、Si、、Fe
②HCl、 、HClO、HClO3、HClO4
(2)从S、H、O、N四种元素中选择适当的元素写出符合下列要求物质的化学式:
①相对分子质量最小的氧化物;
②硫燃烧生成具有刺激性气味的有毒气体 ;
③空气中含量最多且用作食品防腐的气体 ;
④可用于实验室制氧气的是 。
(3)根据题意,写出下列化学符号:
①两个硫酸根离子; ②n个铜原子;③氖气 ;
④保持二氧化碳化学性质的最小粒子;
⑤氧化铝中铝元素的化合价为+3价 ;
如图是一个模拟医疗输氧的简易装置,试完成下列问题:
①在输氧过程中,可以借此观察氧气的输出速率,连接病人鼻孔的应是管(填“A”或“B”);
②此装置还可用于排水法收集气体,先将集气瓶充满水,再将气体从管通入,被收集的气体应具备的性质是;
③还可以用此装置“洗”去氧气中混有的二氧化碳,则气体应从 ___管通入,瓶中所盛的液体可以是。
(9分)现有下图所示的实验装置,请回答问题: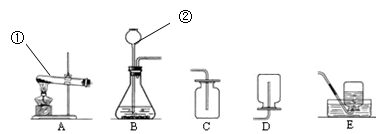
(1)写出标有序号的仪器名称:①_____________,②____________;
(2)要制取一瓶氧气,你认为应选择的最佳实验装置是(填写字母代号)。
加入药品之前应对实验装置进行。
你认为在准备工作阶段除应考虑药品的价格、制氧气反应的难易、制氧气过程的安全性等因素外。还应考虑的因素是。 (列举一条)
(3)写出实验室用A装置制备氧气的文字表达式:。
(4)通过查阅资料得知:①氨气(NH3)是一种密度比空气小且极易溶于水的气体,其水溶液称为氨水;②氨气在加热条件下能与氧化铜反应生成铜、水和空气中含量最多的气体。小芳同学加热氯化铵和氢氧化钙的固体混合物制取氨气,她应选择的反应的发生装置是,收集装置是。(填字母编号)
下列实验技能都是你必须具备的,你能作出正确回答吗?
⑴如何判断玻璃仪器已经洗涤干净?。
⑵加热氯酸钾制氧气,用排水法收集,何时开始?。
⑶洒出的酒精在桌上燃烧起来,如何处理?。