恒压密闭容器中充入2molX和5molY,发生反应: ,温度分别为T1和T2时,X的转化率
,温度分别为T1和T2时,X的转化率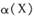 随时间变化的关系如右图所示。则下列结论正确的是
随时间变化的关系如右图所示。则下列结论正确的是
A.达到平衡后,其它条件不变,降低温度,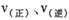 均减小,Y的转化率 均减小,Y的转化率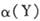 也减小 也减小 |
| B.达到平衡后,其它条件不变,通入稀有气体或者增加M,平衡均向逆反应方向移动 |
| C.当温度为T2时,若开始加人1 mol X,2mol Y ,2 mol Z和1mol M,达到平衡后乙的体积分数约为16.7% |
D.当温度为T1时,若开始加入1molX、2mol Y、2 mol Z和a mol M,达到平衡后若X、Y、Z的物质的量分数与原平衡保持不变,则应满足: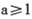 |
下列各物质中不能直接作为炼铁矿石的是()。
| A.磁铁矿 | B.赤铁矿 | C.黄铁矿 | D.菱铁矿 |
复合材料的使用使导弹的射程有了很大的提高,其主要原因是()。
| A.复合材料的使用可以使导弹能经受超高温的变化 |
| B.复合材料的使用可以使导弹的质量减轻 |
| C.复合材料的使用可以使导弹承受温度的剧烈变化 |
| D.复合材料的使用可以使导弹承受超高强度的变化 |
现有两种高聚物A、B,A能溶于氯仿等有机溶剂,加热到一定温度下熔融成粘稠液体,B不溶于溶剂,加热不会变软或熔融。则下列说法中不正确的是()。
A.高聚物A可能具有弹性,而高聚物B一定没有弹性
B.高聚物A一定是线型高分子材料
C.高聚物A一定是体型高分子材料
D.高聚物B一定是线型高分子材料
现在大量使用的塑料,如聚苯乙烯,难以分解而造成的“白色污染”甚为严重。铁道部下今全国铁路餐车停止使用聚苯乙烯制造的餐具,而改用降解塑料 。该塑料在乳酸菌作用下迅速分解为无毒物质,下列有关降解塑料的叙述正确的是()。
。该塑料在乳酸菌作用下迅速分解为无毒物质,下列有关降解塑料的叙述正确的是()。
| A.降解塑料是一种纯净物 | B.其相对分子质量为72 |
| C.经缩聚反应生成 | D.其单体是CH3CO—COOH |
喷水溶液法是最近日本科学家研制出的一种使沙漠变绿洲的新技术,它在沙漠中喷洒一定量的聚丙烯酸酯水溶液,水溶液中的高分子与沙土粒子结合在地表下30~50cm处形成厚0.5cm的隔水层,既能阻止地下的盐分上升,又有拦截、蓄积雨水的作用。下列对聚丙烯酸酯不正确的说法是()。
| A.单体的结构简式为CH2=CH-COOR | B.在一定条件下能发生加成反应 |
| C.在一定条件下能发生水解反应 | D.没有固定的熔沸点 |