将5.52gFeOJe2O3、CnO的混合物加入120mL 1.0mol/L H2SO4溶液中完全溶解,向所得溶液中逐滴加入1.5mol/L NaOH溶液至刚出现沉淀时,消耗NaOH溶液40mL;将等质量的原混合物用CO气体加热还原,则在该实验过程中CO失去电子的物质的量不可能是
| A.0.06mol | B.0.12mol | C.0.18mol | D.0.20mol |
下列说法正确的是
| A.物质发生化学反应时必然伴随着能量变化 |
| B.金属铜导电,故金属铜是电解质 |
| C.自发反应都是熵增大的反应 |
| D.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大 |
下列不能用勒夏特列原理解释的是
| A.Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| B.棕红色NO2加压后颜色先变深后变浅 |
| C.H2、I2、HI平衡混和气加压后颜色变深 |
| D.打开啤酒瓶盖,瓶口冒出大量气泡 |
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是()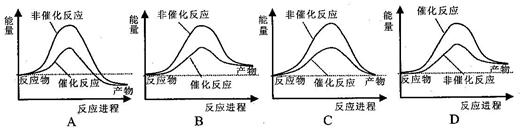
下列说法正确的是
| A.物质的溶解性为难溶,则该物质不溶于水 |
| B.物质的溶解度都随温度的升高而增大 |
| C.绝对不溶于水的物质是不存在的 |
| D.某离子被沉淀完全是指该离子在溶液中的浓度为0 |
在由水电离出的c(H+)= 1×10-13 mol·L-1的溶液中一定能大量共存的离子组是
| A.Fe2+、 Na+、 NO3-、 Cl- | B.Ba2+、Na+、 NO3-、Cl- |
| C.SO42-、C6H5O-、NH4+、Na+ | D.Mg2+、Na+、Br -、AlO2- |