将下列金属投入到1L 2mol/L的盐酸溶液中,产生氢气最多的是:
| A.56gNa | B.56g铁 | C.1molAl | D.1molMg |
下列区别物质的方法错误的是
| A.铝与铝合金—比较硬度 | B.用水区别氯化钠和硝酸铵固体 |
| C.用燃烧的方法区别羊毛和涤纶 | D.用燃着的木条鉴别氮气与二氧化碳 |
下列实验操作正确的是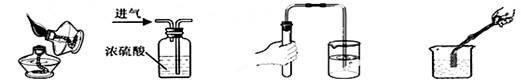
| A.点燃酒精灯 | B.干燥氢气 | C.检查气密性 | D.测定溶液的pH |
“无土栽培”是一项利用化学试剂配成的营养液来栽培植物的新技术.下列是某营养液所含的主要成分,其中属于复合肥料的是
| A.KNO3 | B.CO(NH2)2 | C.Ca(H2PO4)2 | D.(NH4)2SO4 |
依据国家相关法律规定,机动车驾驶员醉驾将受到刑事处罚。检测驾驶员是否酒后驾车,可用一种装有重铬酸钾(K2Cr2O7)的仪器。在K2Cr2O7中Cr元素的化合价是
| A.+2 | B.+3 | C.+6 | D.+7 |
漂白粉的有效成分是
| A.次氯酸钙 | B.氯化钙 |
| C.次氯酸 | D.次氯酸钙与氯化钙 |