实验是进行化学研究的重要手段之一。请回答下列问题:
(1)下列实验操作,错误的是____________________(填写序号)。
a. 用纸槽往试管里装粉末状药品时,试管应先横放再直立
b. 称取氢氧化钠固体时,应将氢氧化钠固体直接放在左边托盘内,右边托盘放砝码
c. 试管、烧杯、量筒、集气瓶都不能用酒精灯直接加热
d.用试纸检验气体性质时,手拿着试纸经水润洗后靠近气体观察试纸颜色的变化
e.闻气体气味时,应取一瓶盛满气体的集气瓶,稍打开玻璃片,用手轻轻扇地在瓶口扇动,使极少量的气体飘进鼻孔,闻气味
(2)实验室需要450mL 0.1mol·L-1NaOH溶液和500mL 0.5 mol·L-1硫酸溶液。请回答下
列问题:
①在右图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器有 。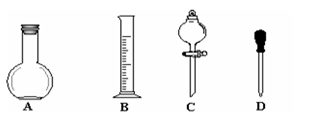
②在容量瓶的使用方法中,下列操作正确的是____________(填写序号)。
a.使用容量瓶前检验是否漏水
b.容量瓶用水洗净后,再用待配溶液洗涤
c.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流注入容量瓶中,然后加蒸馏水。
d.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
③配制450 mL 0.1 mol·L-1 NaOH溶液的实验步骤如下:
a.计算应称取氢氧化钠固体的质量为________g。
b.称量氢氧化钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容
量瓶。
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却。
e.盖好瓶塞,反复上下颠倒,摇匀。
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与
刻度线相切。
上述步骤的正确操作顺序为_______________________(用序号表示)。
④根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为 mL,如果实验室有15mL、20mL、50mL量筒,应选用 mL量筒最好。
二氧化锰与浓盐酸混合加热得到氯气,下图是制取并探究Cl2化学性质的装置图。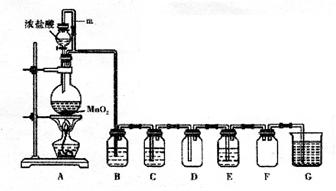
(1)圆底烧瓶中发生反应的化学方程式为。
(2)若要得到干燥纯净的气体,B、C中应分别盛放的试剂为、。
(3)E中若装有FeCl2溶液,反应的离子方程式为,E中若装有淀粉碘化钾溶液,能观察到的实验现象是。
(4)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象某化学兴趣小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸加热
d.MnO2与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是
实验c的目的是
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是 。
。
(1)有Fe2+、NO-3、Fe3+、NH+4、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物。
①请写出该反应的离子方程式(不要求配平)。
②该反应中氧化剂与还原剂的物质的量之比为。
③产生2mol还原产物时转移电子的总数为。
(2)实验室配制0.5mol/L的NaCl溶液500mL,有以下仪器;
①烧杯②100mL量筒③1000 mL容量瓶④500mL容量瓶⑤玻璃棒⑥托盘天平(带砝码)配制时,必须使用的仪器有(填序号),还缺少的仪器是实验两次用到玻璃棒,其作用分别是、。
mL容量瓶④500mL容量瓶⑤玻璃棒⑥托盘天平(带砝码)配制时,必须使用的仪器有(填序号),还缺少的仪器是实验两次用到玻璃棒,其作用分别是、。
(3)有一瓶澄清的溶液,可有含有大量的NO-3、Fe3+、NH+4、H+、K+、Mg2+、Al3+、SO2-4、Ba2+、CO2-3、Cl-、I-,现进行如下实验:
①测知溶液显酸性;
②取样加少量四氯化碳和数滴新制氯水,四氯化碳层溶液呈紫红色;
③另取样滴加稀NaOH溶液,使深液变为碱性,此过程中无沉淀生成;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
⑤ 将实验③中的碱性溶液加热,有气体放出,该气体
将实验③中的碱性溶液加热,有气体放出,该气体 能使湿润的红色石蕊试纸变蓝。
能使湿润的红色石蕊试纸变蓝。
由此可以推断:
溶液中肯定存在的离子有。
溶液中不能确定是否存在的离子有。
.用仪器A、B和胶管组成装置收集NO气体(①仪器A已经气密性检查;②除水外不能选用其他试剂)。
正确的操作步骤是_________________________________
某学习小组用下图装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
(1)A中试剂为______________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是_________________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性。上述操作的顺序是___________;(填序号)记录C的液面位置时,除视线平视外,还应_______________。
(4)B中发生反应的化学方程式为____________________________________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为_______________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________(填“偏大”、“偏小”、“不受影响”)。
有A、B、C、D四种无色溶液,它们分别是Na2CO3、Na2SO4、NaHSO4、
BaCl2中的一种,为了确定各是何种溶液进行了下列实验,记录为:
①A + D → 溶液+ 气体,
②B + C → 溶液+ 沉淀,
③B + A → 溶液+ 沉淀X,
④D + B → 溶液Y + 沉淀,
⑤溶液Y + 沉淀X → 溶液+ 气体。
(1)根据以上记录确定:A_________B__________C__________D________(填化学式)
(2)写出①、③、⑤各反应的离子方程式:
①______________________________
③______________________________
⑤_______________________________