下列事实一定能说明HF是弱酸的是
①常温下NaF溶液的pH大于7; ②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应; ④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体 ⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
| A.①②⑦ | B.②③⑤ | C.③④⑥ | D.①④ |
【化学——选修3:物质结构与性质】X、Y、Z、V、W为五种前四周期元素,其中X是短周期(除稀有气体外)原子半径最大的元素;Y与X同周期,其最高价氧化物的水化物呈两性;Z原子基态时2p原子轨道上有3个未成对的电子;V原子的核外电子排布式为ls22s22p63s2;W的原子序数为29,W的离子能与乙二胺(H2N—CH2一CH2一NH2)形成配离子: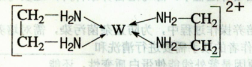
回答下列问题:
(1)W原子的核外电子排布式为,该配离子中含有的化学键类型有。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
(2)元素X、Y、V第一电离能由大到小的顺序是(用元素符号表示)。
(3)Z的氢化物的空间构型是;该氢化物的沸点比甲烷的高,其主要原因是;Z的另一种氢化物Z2H4分子中Z原子轨道的杂化类型是。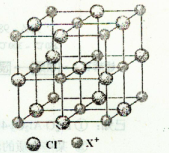
(4)X和Cl元素构成的化合物XCl,XCl的晶胞结构如右图所示,晶体中X+的配位数是;每个X+周围与其紧邻的Cl-围成的几何图形为。
【化学——选修2:化学与技术】碳酸锂用途广泛,可用作陶瓷、药物、催化剂,也是常用的锂离子电池的原料。工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:①Li2O·Al2O3·4SiO2+H2SO4(浓) Li2SO4+Al2O3·H2O↓
Li2SO4+Al2O3·H2O↓
②某些物质的溶解度(S)如下表所示。
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。
则步骤I中反应的离子方程式是,步骤Ⅱ应通入一种气体试剂为,步骤II反应完之后需要的操作是。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液l中加入石灰乳的作用是(用离子方程式表示)。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是。
(4)工业上,将Li2CO3粗产品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过 量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是。
②b中,生成Li2CO3反应的化学方程式是。
在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:
(1)铜与浓硫酸反应,实验装置如图所示。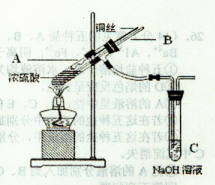
①装置A中发生反应的化学方程式为;
②上图装置中导管B的作用你认为可能是(写出一种)。
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在(填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过、、过滤、洗涤、干燥,即可得到产品CuSO4·5H2O晶体,干燥需要控制温度小于100℃,若温度过高,则会导致。
(3)将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量:FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:2Fe3++Cu=2Fe2++Cu2+,请写出其第l步反应的离子方程式。
(4)制取的CuSO4溶液和“另一物质”在40-50℃混合时生成了一种难溶物质氢化亚铜(CuH)。将CuH溶解在稀盐酸中时生成了一种气体,这种气体是,经收集测定生成的该气体为标况下11.2 L,则被还原的离子得电子的物质的量是(已知Cu+在酸性条件下发生反应2Cu+=Cu2++Cu)。
工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下: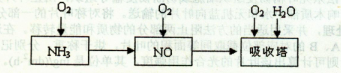
(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式。当温度升高时,化学平衡常数K值(填“增大”、“减小”、“无影响”)。
(2)硝酸厂尾气常用的处理方法是:催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+67.7 kJ/mol
H2O(1)=H2O(g)△H=+44.0 kJ/mol
则8g H2恰好将NO2转化成N2和H2O(1)时△H=。
(3)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2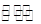 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。
①下列各项标志着该反应达到化学平衡状态的是(填字母)。
| A.容器内N2、H2、NH3的浓度之比为l:3:2 |
B.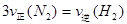 |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2 L固定容积的密闭容器中,5 min后反应达平衡时,n(N2)=1.2 mol,n(H2)=1.2 mol, n(NH3)=0.8 mol,则反应速率v(N2)=,平衡常数=(保留两位小数)。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡(填向左、向右或不移动)移动。
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl一、NO3-、SO42-、CO32-。已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加人氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
回答下列问题:
(1)五种盐中,一定没有的阳离子是;所含的阴离子相同的两种盐的化学式是。
(2)D的化学式为,D溶液显碱性原因是(用离子方程式表示)。
(3)A和C的溶液反应的离子方程式是:;E和氨水反应的离子方程式是:。
(4)若要检验B中所含的阳离子,正确的实验方法是。