将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),
如图所示。导致该现象的主要原因是液滴下面的氧气
含量比液滴边缘少。下列说法正确的是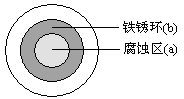
| A.(a)区腐蚀比(b)区腐蚀严重 |
| B.该过程发生了化学反应:4Fe+3O2→2Fe2O3 |
| C.该过程是析氢腐蚀,负极反应为:Fe-2e →Fe2+ |
| D.该过程为吸氧腐蚀,正极反应为:O2+2H2O+4e→4OH- |
下列有机反应中,不属于取代反应的是
A. +Cl2 +Cl2 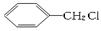 +HCl +HCl |
B.2CH3CH2OH+O2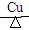 2CH3CHO+2H2O 2CH3CHO+2H2O |
C.ClCH2CH===CH2+ NaOH HOCH2CH===CH2+NaCl HOCH2CH===CH2+NaCl |
D. +HO—NO2 +HO—NO2  +H2O +H2O |
乙醇分子中各种化学键如下图所示,关于乙醇在各种反应中断裂键的说法不正确的是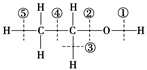
| A.和金属钠反应时键①断裂 |
| B.和浓H2SO4共热到170℃时键②和⑤断裂 |
| C.和浓H2SO4共热到140℃时仅有键②断裂 |
| D.在Ag催化下与O2反应时键①和③断裂 |
CH3CH2C≡CH的化学性质主要取决于
A.碳碳单键(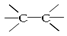 ) ) |
B.碳碳双键(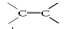 ) ) |
| C.碳碳三键(—C≡C—) | D.碳氢键( ) )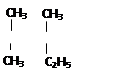 |
下列有机物分子中,所有原子不可能处在同一平面的是
| A.CH2==="CH—CN" | B.CH≡CH |
C.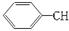 ===CH2 ===CH2 |
D. |
1 mol X能与足量碳酸氢钠溶液反应放出44.8 L CO2(标准状况),则X的分子式是
| A.C5H10O4 | B.C4H8O4 | C.C3H6O4 | D.C2H2O4 |