下列有关工业生产的叙述正确的是
| A.合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.联合制碱法是将二氧化碳和氨气通入饱和氯化钠溶液中,制得碳酸氢钠,再在高温下灼烧,转化为碳酸钠。 |
| C.硫酸工业中,在接触室安装热交换器是利用SO3转化为H2SO4时放出的热量 |
| D.电解饱和食盐水制烧碱采用离子交换膜,可防止阳极室产生的C12进入阴极室 |
溶液、胶体和浊液这三种分散系的根本区别是[]
| A.能否透过滤纸 | B.能否发生丁达尔效应 |
| C.分散质粒子的大小 | D.是否均一、透明、稳定 |
实验室装有浓硫酸的试剂瓶应贴有的图标是[ ]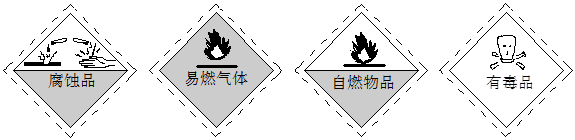
AB CD
2012年10月10日北京时间17时45分诺贝尔奖评委会宣布,2012年度诺贝尔化学奖授予美国科学家罗伯特·洛夫科维茨以及布莱恩·克比尔卡,因为他们在 “G蛋白偶联受体”研究方面作出了突破性贡献。G蛋白偶联受体是我们细胞膜上的一种蛋白质,它好比是一把锁,它可以被打开,打开之后就可以引发一系列的各种化学反应。下列叙述正确的是[ ]
| A.G蛋白偶联受体是一把锁 |
| B.G蛋白偶联受体是我们细胞膜上的一种蛋白质 |
| C.研究“G蛋白偶联受体”不涉及化学学科知识 |
| D.研究“G蛋白偶联受体”不涉及生物学科知识 |
将铝片和铜片用导线相连,一组插入浓HNO3溶液中,一组插入稀NaOH溶液中,分别形成了原电池,则在这两个原电池中,正极分别为
| A.铝片、铜片 | B.铜片、铝片 |
| C.铝片、铝片 | D.铜片、铜片 |
可逆反应2SO2+O2 2SO3,若用2 mol SO2和1 mol 18O2在一定条件下,经足够长的时间反应,下列情况可能出现的是
2SO3,若用2 mol SO2和1 mol 18O2在一定条件下,经足够长的时间反应,下列情况可能出现的是
| A.容器中只有三氧化硫 |
| B.18O原子存在于氧气、二氧化硫、三氧化硫中 |
| C.生成2 mol 三氧化硫 |
| D.18O原子完全存在于三氧化硫中 |